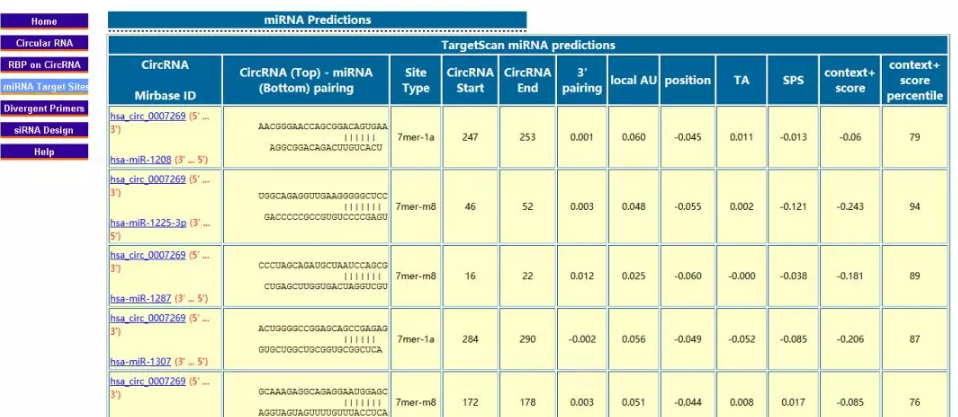
|
circRNAĄ─Č©┴x║═╠žš„
Łh(hu©ón)ĀŅRNA (circRNA)╩Ūę╗ŅÉą┬Ą─Š▀ėąš{(di©żo)┐ž╣”─▄Ą─ĘŪŠÄ┤aRNAŻ¼Š▀ėąķ]║ŽŁh(hu©ón)ĀŅĮY(ji©”)śŗ(g©░u)Ż¼┤¾┴┐┤µį┌ė┌šµ║╦▐D(zhu©Żn)õøĮMųąĪŻ┤¾▓┐ĘųĄ─Łh(hu©ón)ĀŅRNA╩Ūė╔═Ō’@ūėą“┴ąśŗ(g©░u)│╔Ż¼į┌▓╗═¼Ą─╬’ĘNųąŠ▀ėą▒Ż╩žąįŻ¼═¼Ģr┤µį┌ĮM┐Ś╝░▓╗═¼░l(f©Ī)ė²ļAČ╬Ą─▒Ē▀_╠ž«ÉąįĪŻė╔ė┌Łh(hu©ón)ĀŅRNAī”║╦╦ß├Ė▓╗├¶ĖąŻ¼╦∙ęį▒╚ŠĆąįRNAĖ³×ķĘĆ(w©¦n)Č©Ż¼▀@╩╣Ą├Łh(hu©ón)ĀŅRNAį┌ū„×ķą┬ą═┼R┤▓į\öÓś╦ėø╬’Ą─ķ_░l(f©Ī)æ¬(y©®ng)ė├╔ŽŠ▀ėą├„’@ā×(y©Łu)ä▌ĪŻ
|
circRNAį┌▓Ė╚ķäė╬’╝Ü░¹ųąĄ─ą╬│╔
|
|
circRNA╠žš„
• circRNAø]ėąĪ░╬▓░═Ī▒
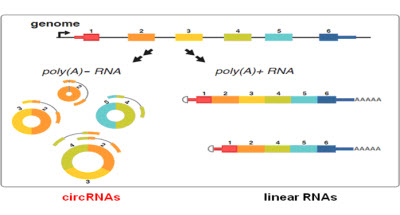
│ŻęÄ(gu©®)┤µį┌ė┌ŠĆąįRNAĘųūėųąĄ─3Ī»║═5Ī»Č╦į┌Łh(hu©ón)ĀŅRNAųą▒╗▀BĮėą╬│╔┴╦ķ]║ŽŁh(hu©ón)ĀŅĮY(ji©”)śŗ(g©░u)Ż©łD1Ż®ĪŻČ°Įø(j©®ng)ĄõĄ─RNAÖz£yĘĮĘ©ų╗─▄ĘųļxŠ▀ėąPolyAĪ░╬▓░═Ī▒ĮY(ji©”)śŗ(g©░u)Ą─RNAĘųūėŻ¼╦∙ęįŁh(hu©ón)▐D(zhu©Żn)RNAį┌ęį═∙Ą─蹊┐ųą═©│Ż▒╗║÷┬į┴╦ĪŻ
• circRNA▓╗ĘŁūg
ļm╚╗║▄ČÓcircRNA╩Ūė╔Ą░░ūŠÄ┤a╗∙ę“«a(ch©Żn)╔·Ż¼Ą½╩Ū▀Ćø]ėąĮY(ji©”)╣¹’@╩ŠcircRNAį┌╝Ü░¹ųąŠÄ┤aĄ░░ūĪŻŁh(hu©ón)ĀŅRNAę▓ę“┤╦▒╗Č©┴x×ķę╗ŅÉą┬ą═ĘŪŠÄ┤aRNAĪŻ
• circRNAĄ─╝Ü░¹Č©╬╗║═ĘĆ(w©¦n)Č©ąį
┤¾▓┐ĘųŁh(hu©ón)ĀŅRNAį┌╝Ü░¹Ø{ųąĖ╗╝»Ż¼ŲõžSČ╚ėąĢr╔§ų┴▒╚ŽÓæ¬(y©®ng)Ą─ŠĆąįmRNAĖ▀10ėÓ▒ČŻ¼▀@┐╔─▄╩Ūė╔ė┌Łh(hu©ón)ĀŅRNA▒╚ŠĆąįRNAĖ³ĘĆ(w©¦n)Č©įņ│╔Ą─ĪŻ║╦╦ß├Ė═∙═∙═©▀^ūRäeŠĆąįRNAĘųūė─®Č╦░l(f©Ī)ō]ū„ė├Ż¼Łh(hu©ón)ĀŅRNA╩Ūę╗éĆķ]║ŽĮY(ji©”)śŗ(g©░u)Ż¼ę“┤╦ī”║╦╦ß├ĖŠ▀ėąĖ▀─═╩▄ąįĪŻ
|
|
ć°╝ęūį╚╗┐ŲīW╗∙Į×ķ║╬╚ń┤╦Ī░ńŖÉ█Ī▒circRNA
Į³─ĻüĒcircRNA蹊┐╚ń╗╚ń▌▒Ż¼ć°ā╚(n©©i)蹊┐ę▓Šoūź¤ß³cŻ¼▀@ę╗³cÅ─ć°╝ęūį╚╗┐ŲīW╗∙ĮĄ─āAŽ“ąį┐╔ęŖę╗░▀Ż║Å─2016─ĻĄ─╝s80ĒŚcircRNAŽÓĻP(gu©Īn)ĒŚ─┐Ż¼ĄĮ2017─ĻĄ─176ĒŚŻ©░³└©2ĒŚĮ▄│÷ŪÓ─Ļ╗∙ĮŻ¼1ĒŚā×(y©Łu)ąŃŪÓ─Ļ╗∙ĮŻ¼2ĒŚųž³cĒŚ─┐Ż¼94ĒŚ├µ╔ŽĒŚ─┐Ż¼62ĒŚŪÓ─Ļ╗∙ĮĒŚ─┐Ż¼15ĒŚĄžģ^(q©▒)┐ŲīW╗∙ĮĒŚ─┐Ż® Ż¼į┘ĄĮ2018─ĻĄ─200ČÓĒŚŻ©░³└©87ĒŚ├µ╔ŽĒŚ─┐Ż¼11ĒŚĄžģ^(q©▒)╗∙ĮĒŚ─┐Ż¼65ĒŚŪÓ─Ļ╗∙ĮĒŚ─┐Ą╚Ż®ĪŻ
ŲõųąŻ¼─[┴÷īWĒŚ─┐½@┼·ūŅČÓŻ¼╚ńųą┐Ųį║╔·╬’╬’└Ē╦∙Ą─Ī░Łh(hu©ón)ą╬RNA CircDcun1d4š{(di©żo)┐žĖ╬░®Ė╔╝Ü░¹ūį╬ęĖ³ą┬Ą─ū„ė├╝░ĘųūėÖCųŲ蹊┐Ī▒Ż¼ųą╔Į┤¾īWĄ─Ī░Łh(hu©ón)ĀŅRNAĮķī¦─[┴÷ŽÓĻP(gu©Īn)Š▐╩╔╝Ü░¹┤┘▀MĘ╬░®▐D(zhu©Żn)ęŲ蹊┐Ī▒Ą╚Ą╚ĪŻ
|
circRNAĄ─░l(f©Ī)š╣┬Ę│╠
|
1971─ĻŻ¼čąŠ┐š▀░l(f©Ī)¼F(xi©żn)ŅÉ▓ĪČŠŻ©ViroidsŻ®─▄Ūų╚Šų▓ųĻ▓óī¦ų┬╦└═÷Ż¼┼c▓ĪČŠ▓╗═¼Ą─╩ŪŻ¼ŅÉ▓ĪČŠø]ėąĄ░░ū┘|(zh©¼)═ŌÜż░³▒╗Ż¼╗∙ę“ĮM╩Ūå╬µ£Īóķ]║ŽĪóRNAĘųūėĪŻ
1993─ĻŻ¼į┌ąĪ╩¾Š½ūėøQČ©╗∙ę“Sryųą░l(f©Ī)¼F(xi©żn)Łh(hu©ón)ĀŅ▐D(zhu©Żn)õøĪŻ
2006─ĻŻ¼į┌╣¹Žēųą░l(f©Ī)¼F(xi©żn)üĒūįė┌MuscleblindĄ─╬┤ų¬Łh(hu©ón)ĀŅ▐D(zhu©Żn)õø▒ŠĪŻ
2012─ĻŻ¼Salzman═©▀^RNA-SeqĘĮĘ©╩ū┤╬ł¾Ą└┴╦~80éĆŁh(hu©ón)ĀŅRNAĪŻų┴┤╦ĮĶų·ė┌Ė▀═©┴┐£yą“╝╝ąg(sh©┤)Ż¼circRNA▓┼šµš²×ķūį╝║š²├¹ĪŻ┤¾┴┐Ą─circRNAĘųūė▒╗ŽÓ└^░l(f©Ī)¼F(xi©żn)ĪŻ
2013─ĻŻ¼NatureļsųŠā╔Ų¬ųžę¬Ą─蹊┐šō╬─Įę╩Š│÷ę╗ą®Łh(hu©ón)ĀŅRNA│õ«öĘųūėĪ░║ŻŠdĪ▒Ż¼ĮY(ji©”)║Ž▓óĘŌķ]┴╦microRNAsĪŻūį┤╦Ż¼Łh(hu©ón)ĀŅRNAį┌┐ŲīWĮń╩▄ĄĮ┴╦Ū░╦∙╬┤ėąĄ─ĻP(gu©Īn)ūóĪŻ
|
1979─ĻŻ¼┬Õ┐╦ĘŲ└š┤¾īWĄ─Hsu║═Coca-Pradosį┌ļŖūė’@╬óńRŽ┬ė^▓ņĄĮĄ─šµ║╦╝Ü░¹╝Ü░¹┘|(zh©¼)ųąė^£yĄĮŁh(hu©ón)ĀŅRNAĄ─┤µį┌ĪŻ
2014─ĻŻ¼circRNAųØu│╔×ķ┴╦RNAŅI(l©½ng)ė“Ą─蹊┐¤ß³cŻ¼Arraystar╣½╦Š╚½Ū“╩ū═ŲĄ┌ę╗┐Ņ╔╠śI(y©©)╗»circRNAąŠŲ¼ĪŻ
2015─ĻŻ¼ųąć°▐r(n©«ng)śI(y©©)┐ŲīWį║ų▓╬’▒Żūo蹊┐╦∙蹊┐åT└Ņ╩└įL┼cųąć°┐ŲīW╝╝ąg(sh©┤)┤¾īWģŪŪÕ░l(f©Ī)Į╠╩┌║Žū„Ż¼į┌╩└Įń╔Ž╩ū┤╬░l(f©Ī)¼F(xi©żn)╠O╣¹ųą┤µį┌Š▀ėą║╦├Ė╗ŅąįĄ─Łh(hu©ón)ĀŅRNAĪŻ
2017─ĻŻ¼Ą┬ć°┐ŲīW╝ę░l(f©Ī)¼F(xi©żn)Łh(hu©ón)ĀŅRNA┼c┤¾─X╣”─▄┤µį┌ĻP(gu©Īn)┬ō(li©ón)ĪŻ
2018─ĻŻ¼įĮüĒįĮČÓĄ─蹊┐ūCīŹŁh(hu©ón)ĀŅRNA┼c░®░Y├▄ŪąŽÓĻP(gu©Īn)Ż¼ėą═¹│╔×ķ░®░Y╔·╬’ś╦ėø╬’
|
|
Ī░▀^╚źŻ¼╚╦éā┤¾ČÓ░čcircRNA┐┤ū„╩ŪŲµ╣ųĄ─¼F(xi©żn)Ž¾ĪŻļSų°Č■┤·£yą“Ą─░l(f©Ī)š╣Ż¼ūŅĮ³╦─╬Õ─Ļ╚╦éā░l(f©Ī)¼F(xi©żn)▀@ą®ĘųūėŲõīŹ╩Ū
ĘŪ│ŻŲš▒ķĄ─ĪŻ▀@ę╗╚½ą┬ŅI(l©½ng)ė“į┌║▄Č╠Ģrķgā╚(n©©i)Ą├ĄĮ┴╦’w╦┘░l(f©Ī)š╣ĪŻĪ▒
|
Ī¬Ī¬ŽŻ▓«üĒ┤¾īWĄ─Sebastian Kadener |
circRNAĄ─╣”─▄┼cū„ė├
|
circRNAĖéĀÄąį╬³ĖĮmiRNA
circRNA┼cŽÓæ¬(y©®ng)microRNAĮY(ji©”)║ŽŻ¼Ž±Ī░║ŻŠdĪ▒╬³ĖĮmiRNAŻ¼╩╣miRNA¤oĘ©┼c░ą╗∙ę“ĮY(ji©”)║ŽŻ¼▀MČ°╣▓═¼ģó┼cš{(di©żo)┐ž░ą╗∙ę“Ą─▒Ē▀_ĪŻ▀@ę╗ū„ė├ÖCųŲ▒╗ĘQ×ķĖéĀÄąįā╚(n©©i)į┤RNAŻ©ceRNAŻ®ÖCųŲĪŻ═©▀^┼c╝▓▓ĪĻP(gu©Īn)┬ō(li©ón)Ą─miRNAŽÓ╗źū„ė├Ż¼ circRNAį┌╝▓▓Īųą░l(f©Ī)ō]ų°ųžę¬Ą─š{(di©żo)┐žū„ė├Ż¼▀@ę╗³c╩Ū─┐Ū░circRNAūŅų„ꬥ─蹊┐╦╝┬ĘĪŻ
circRNAsš{(di©żo)┐ž┐╔ūā╝¶Ūą╗“▐D(zhu©Żn)õø▀^│╠
circRNA═©▀^ēA╗∙╗źča┼õī”ų▒Įėš{(di©żo)┐žŲõ╦¹RNA╦«ŲĮŻ¼circRNA┐╔─▄ģó┼cĄ░░ūĘŁūgĪŻę╗ų▒▒╗šJ×ķ╩ŪĘŪŠÄ┤aRNAĄ─circRNAę▓─▄ŠÄ┤aČÓļ─Ż¼▓ó═©▀^Ųõąą╩╣╣”─▄ĪŻcircMbl╩Ūė╔╝¶Ūąę“ūėMBLĄ─Ą┌Č■éĆ═Ō’@ūėŁh(hu©ón)╗»Č°üĒŻ¼ĖéĀÄmRNAĄ─ŠĆąį╝¶ŪąĪŻCircMblĄ─é╚(c©©)ęĒ═Ō’@ūė║═ūį╔Ēą“┴ą░³║¼MBL╠ž«ÉąįĮY(ji©”)║ŽĄ─╬╗³cĪŻMBLĄ─▒Ē▀_╦«ŲĮ╩▄ĄĮcircMblĄ─š{(di©żo)┐žė░ĒæĪŻčąŠ┐▒Ē├„Ż¼MBL═©▀^š{(di©żo)š¹circRNAą╬│╔║═ŠĆąį┐╔ūā╝¶Ūąų«ķgĄ─ŲĮ║ŌüĒė░Ēæ┐╔ūā╝¶Ūą▀^│╠ĪŻforminŻ©FmnŻ®╗∙ę“┐╔ęį═©▀^backsplicingą╬│╔circRNAĪŻįōcircRNA░³║¼ĘŁūgŲ╩╝╬╗³cū„×ķĪ░mRNA trapĪ▒Ż¼ą╬│╔ę╗éĆĘŪŠÄ┤aŠĆąį▐D(zhu©Żn)õø▒ŠČ°£p╔┘FmnĄ░░ūĄ─▒Ē▀_ĪŻ
|
|
circRNAš{(di©żo)╣Ø(ji©”)RNAĮY(ji©”)║ŽĄ░░ūŻ©RBPŻ®
circRNA─▄┼cĄ░░ū┘|(zh©¼)ĮY(ji©”)║ŽŻ¼ęųųŲĄ░░ū┘|(zh©¼)╗ŅąįĪó─╝╝»Ą░░ū┘|(zh©¼)Å═║Ž¾wĄ─ĮMĘų╗“š{(di©żo)┐žĄ░░ū┘|(zh©¼)Ą─╗Ņąį, circRNA┐╔─▄ģó┼cĄ░░ūĘŁūgĪŻę╗ų▒▒╗šJ×ķ╩ŪĘŪŠÄ┤aRNAĄ─circRNAę▓─▄ŠÄ┤aČÓļ─Ż¼▓ó═©▀^Ųõąą╩╣╣”─▄ĪŻ
circRNA┼c┤¾─X╣”─▄
circRNA┐╔─▄ī”┤¾─X╣”─▄║▄ųžę¬ĪŻ▒╚╚ńšfŻ¼ę╗ĘN├¹×ķCDR1Ą─▓Ė╚ķäė╬’circRNAį┌╔±Įø(j©®ng)į¬ųą║¼┴┐║▄Ė▀Ż¼╔±Įø(j©®ng)į¬╗∙ę“Įø(j©®ng)│Ż«a(ch©Żn)╔·circRNA▐D(zhu©Żn)õø▒ŠŻ¼į┌╦ź└Ž▀^│╠ųącircRNAĢ■į┌╣¹Žē┤¾─Xųą└█ĘeĪŻ▓╗▀^╚╦éāø]─▄╚½├µ┴╦ĮŌ▓Ė╚ķäė╬’┤¾─XųąĄ─circRNAĪŻ
|
|
Ī░└ĒĮŌŁh(hu©ón)ĀŅRNAį┌┤¾─X╗“Ųõ╦¹Ų„╣┘ųąĄ─╣”─▄Ż¼īó╩Ū╔·╬’īWĄ─ųž┤¾▀M▓ĮĪŻĪ▒
|
Ī¬Ī¬╦╣╠╣ĖŻ┤¾īWĄ─Ęųūė╔·╬’īWĮ╠╩┌Julia Salzman |
circRNAĄ─蹊┐╦╝┬Ę┼cĘĮĘ©
ęįųą┐Ųį║╔·╬’╬’└Ē蹊┐╦∙Ą─ĘČūµ╔ŁĮ╠╩┌šnŅ}ĮM2018─Ļ░l(f©Ī)▒Ēį┌ć°ļHų¬├¹īWąg(sh©┤)Ų┌┐»ImmunityŻ©IF=22.845Ż®Ą─╬─š┬×ķ└²Ż║
Ż©ąŠŲ¼īŹ“×ė╔┐Ą│╔╔·╬’╠ß╣®╝╝ąg(sh©┤)Ę■äš(w©┤)Ż®
蹊┐╚╦åT└¹ė├Arraystar Mouse CircRNA Array蹊┐┴╦ąĪ╩¾╣Ū╦Ķ╝Ü░¹Ż©BMŻ®ųąĘųļxĄ─ķLŲ┌įņč¬Ė╔╝Ü░¹Ż©LT-HSCsŻ®║═ČÓ─▄Ė╔╝Ü░¹Ż©MPPsŻ®Ą─circRNAs▒Ē▀_ūVŻ¼║Y▀x│÷ę╗éĆį┌LT-HSCs╝Ü░¹║╦Ė▀▒Ē▀_Ą─circRNA cia-cGASŻ¼┐╔ęį┼cDNA├¶ĖąĄ─cGAMP║Ž├ĖcGASŽÓ╗źĮY(ji©”)║Ž▓óęųųŲŲõ├Ė╗ŅąįŻ¼ūĶĄKcGASĮY(ji©”)║Ž╗∙ę“ĮMDNAŻ¼Å─Č°▓╗─▄╝ż╗ŅI(l©½ng)ą═Ė╔ö_╦žŻ©IFNŻ®Ą─▒Ē▀_Ż¼ŠS│ųLT-HSCsĄ─ņoŽóĀŅæB(t©żi)ĪŻįō蹊┐═¼Ģrę▓░l(f©Ī)¼F(xi©żn)cia-cGAS╩ŪcGASĮķī¦Ą─ūį╔Ē├Ōę▀ŽÓĻP(gu©Īn)Ą─ėąą¦ęųųŲ䮯¼×ķėąą¦Ę└ų╬ūį╔Ē├Ōę▀ąį╝▓▓Ī┼cč¬ę║ŽĄĮy(t©»ng)É║ąį─[┴÷╠ß╣®┴╦ą┬╦╝┬Ę║═Øōį┌╦Ä╬’čą░l(f©Ī)░ąś╦ĪŻčąŠ┐│╔╣¹2018─Ļ░l(f©Ī)▒Ēį┌ć°ļHų¬├¹īWąg(sh©┤)Ų┌┐»ImmunityŻ©IF=22.845Ż®ĪŻ
|
ę╗Īó蹊┐▒│Š░
ķLŲ┌įņč¬Ė╔╝Ü░¹Ż©LT-HSCsŻ®╩ŪØō─▄ūŅĖ▀Ą─Ė╔╝Ü░¹ŽĄŻ¼Š▀ėąūŅĖ▀Ą─Ė³ą┬║═Ęų╗»─▄┴”Ż¼┐╔ęį×ķČ╠Ų┌įņč¬Ė╔╝Ü░¹ĪóČÓ─▄Ė╔╝Ü░¹Ż©MPPsŻ®Ą╚╠ß╣®┴╦│ų└m(x©┤)ąį╝Ü░¹čaĮoĪŻ┤¾ČÓöĄ(sh©┤)Ģr║“Ż¼LT-HSCs╠Äė┌ą▌├▀Ą─ņoŽóĀŅæB(t©żi)Ż¼ŲõĖ╔ąįĄ─ŠS│ų╩▄ČÓĘNę“╦žĄ─ė░ĒæĪŻ
|
|
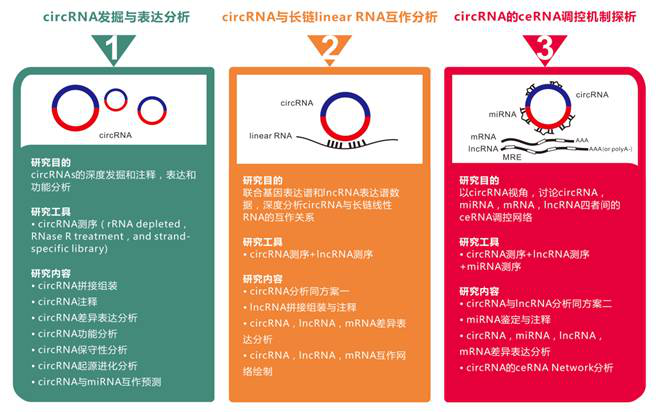
Č■Īó蹊┐╦╝┬Ę+╝╝ąg(sh©┤)┬ĘŠĆ
Step 1 ║Y▀x
蹊┐╚╦åT═©▀^Arraystar Mouse CircRNAąŠŲ¼Ęų╬÷┴╦ąĪ╩¾╣Ū╦ĶųąĘųļxĄ─ķLŲ┌įņč¬Ė╔╝Ü░¹LT-HSC┼cČÓ─▄Ė╔╝Ü░¹MPPsĄ─circRNAs▒Ē▀_ūVŻ¼║Y▀x│÷156ĘN▓Ņ«É▒Ē▀_Ą─circRNAsĪŻqPCR“×ūCĮY(ji©”)╣¹┼cąŠŲ¼ę╗ų┬ĪŻ
Step 2 ĶbČ©
shRNA┬²▓ĪČŠ▐D(zhu©Żn)╚Š░l(f©Ī)¼F(xi©żn)Ż¼ų╗ėąD430042O09Rik╗∙ę“▐D(zhu©Żn)õøĄ─circRNA cia-cGAS┐╔ęįė░ĒæLT-HSCcĄ─üå╚║Ęų▓╝ĪŻ
Step 3 ▒Ē▀_Ęų╬÷
ļS║¾čąŠ┐╚╦åT═©▀^qPCRĪóNorthern blotĪó║╦┘|(zh©¼)Ęųļx╝░įŁ╬╗ļsĮ╗īŹ“×░l(f©Ī)¼F(xi©żn)cia-cGASį┌LT-HSCsĄ─╝Ü░¹║╦ā╚(n©©i)Ė▀Č╚▒Ē▀_ĪŻ
Step 4 ╣”─▄Ęų╬÷
ĮėŽ┬üĒū„š▀ī”cia-cGASĄ─ŽÓĻP(gu©Īn)╣”─▄▀Mąą┴╦蹊┐ĪŻū„š▀═©▀^äh│²Ž┬ė╬Ą─Ę┤Ž“╗źčaą“┴ą╠ž«ÉąįŪ├│²cia-cGASŻ¼F(xi©żn)ACSĘų╬÷▒Ē├„Ū├│²║¾LSK╝Ü░¹├„’@į÷ČÓŻ¼LT-HSC├„’@£p╔┘Ż¼▓óŪęŪ├│²║¾LT-HSCsĄ─BrdU╚Š╔½Ļ¢ąį┬╩├„’@Ė▀ė┌ī”ššĮMŻ¼▒Ē├„Ū├│²║¾LT-HSCs╠Äė┌╗Ņ▄SĄ─į÷ų│ļAČ╬ĪŻ├}ø_ś╦ėøę▓’@╩ŠŪ├│²║¾LT-HSCs╝Ü░¹ņoŽóĀŅæB(t©żi)Ą─▒╚└²’@ų°ĮĄĄ═ĪŻ╚╗║¾ū„š▀═©▀^ī”Ū├│²ąĪ╩¾Ą─mRNA▒Ē▀_ūVĘų╬÷░l(f©Ī)¼F(xi©żn)Ią═IFN▒Ē▀_’@ų°╔Žš{(di©żo)Ż¼qPCR║═ELISAę▓“×ūC┴╦▀@ę╗ĮY(ji©”)╣¹ĪŻęį╔ŽīŹ“×▒Ē├„cia-cGAS┐╔ęį═©▀^Ią═IFNą┼╠¢é„ī¦š{(di©żo)┐žLT-HSCsĄ─ņoŽóĀŅæB(t©żi)ĪŻ
Step 5 ĘųūėÖCųŲĘų╬÷
ūŅ║¾ū„š▀ī”cia-cGAS░l(f©Ī)ō]╣”─▄Ą─ĘųūėÖCųŲ▀Mąą┴╦╠ĮėæĪŻRNA pull downĪóRIPĪó├Ōę▀¤╔╣ŌĪóEMSA║═FISHīŹ“×░l(f©Ī)¼F(xi©żn)cia-cGAS┐╔ęį║═cGASĄ░░ūŽÓ╗źū„ė├ĪŻĮėŽ┬üĒū„š▀═©▀^├Ė╗Ņ£yČ©ĪóChIPĪóHPLCĪó¤╔╣Ō╦ž├Ė║═┘|(zh©¼)ūVīŹ“×▒Ē├„cia-cGAS┐╔ęįūĶĄKcGAS┼cLT-HSCsūį╔ĒDNAĮY(ji©”)║ŽŻ¼Å─Č°ęųųŲŲõ├Ė╗ŅąįŻ¼▓╗─▄╝ż╗ŅI(l©½ng)ą═IFNĄ─▒Ē▀_ĪŻ╚╗║¾ū„š▀ė├CRISPR/Cas9═╗ūācGAS╗∙ę“Ż¼qPCRĪóELISAĪóBrdUś╦ėøĄ╚īŹ“×▒Ē├„Ż¼═╗ūā║¾Ią═IFN▒Ē▀_▒╗ęųųŲŻ¼LT-HSCs╝Ü░¹öĄ(sh©┤)┴┐š²│ŻŪęĖ³ČÓĄ─ŠS│ųį┌ņoŽóĀŅæB(t©żi)ĪŻ▀@ą®Š∙▒Ē├„┴╦cia-cGASū„ė├Ą─ÖCųŲŠ═╩Ū═©▀^ĮY(ji©”)║ŽcGASęųųŲŲõ▒Ē▀_Ż¼Å─Č°▓╗─▄╝ż╗ŅI(l©½ng)ą═IFNĄ─▒Ē▀_Ż¼ŠS│ųLT-HSCĄ─ņoŽóĀŅæB(t©żi)ĪŻäė╬’īŹ“×’@╩ŠŻ¼į┌cia-cGASŪ├│²Ą─ąĪ╩¾ųąŻ¼polyŻ©I:CŻ®┼cHSV▓ĪČŠĄ─┤╠╝żŠ∙┐╔ī¦ų┬┤¾┴┐Ią═Ė╔ö_╦žĄ─«a(ch©Żn)╔·Ż¼Å─Č°šT░l(f©Ī)ūį╔Ē├Ōę▀ąį╝▓▓ĪŻ¼Č°cia-cGAS▀^▒Ē▀_ät┐╔ęįŽ¹│²▀@ą®Ż¼▒Ē├„cia-cGAS╩ŪcGASĮķī¦Ą─ūį╔Ē├Ōę▀╝▓▓ĪĄ─ėąą¦ęųųŲä®ĪŻ
|
Ą┌Č■éĆ└²ūėŻ║┐┤▓▄č®Ø²į║╩┐╚ń║╬ū÷circRNA蹊┐ŻĪ |
▓▄č®Ø²į║╩┐šnŅ}ĮM║═Ą┌Č■▄Ŗßt(y©®)┤¾īWė┌ęµ╦ćĮ╠╩┌šnŅ}ĮM║Žū„į┌Ė╬┼KŅI(l©½ng)ė“Ēö╝ŌļsųŠHepatologyŻ©IF=13.246Ż®░l(f©Ī)▒Ē┴╦Ņ}×ķĪ░Circular RNA MTO1 acts as the sponge of miR-9 to suppress hepatocellular carcinoma progressionĪ▒Ą─╬─š┬Ż¼čąŠ┐╩¦š{(di©żo)Ą─circRNA║═Ė╬░®ųąĄ─╣”─▄ĪŻ
Ż©ąŠŲ¼īŹ“×ė╔┐Ą│╔╔·╬’╠ß╣®╝╝ąg(sh©┤)Ę■äš(w©┤)Ż® |
ę╗Īó蹊┐▒│Š░
Ė╬╝Ü░¹░®Ż©HCCŻ®╩Ūę╗ĘNĖ▀╦└═÷┬╩Ą─įŁ░l(f©Ī)ąįĖ╬░®Ż¼╩ŪūŅ│ŻęŖĄ─É║ąį─[┴÷ų«ę╗ĪŻę╗ą®ā╚(n©©i)į┤ąįĄ─ĘŪŠÄ┤aRNA╚ńcircRNAį┌░l(f©Ī)ė²Īó╝Ü░¹╣”─▄║═╠žČ©Ą─▓Ī└ĒīWæ¬(y©®ng)┤ųą░l(f©Ī)ō]ųžę¬ū„ė├Ż¼╩╣Ą├ī”╩¦š{(di©żo)Ą─ĘŪŠÄ┤aRNAį┌░®░Y╔·╬’īWųąĄ─ū„ė├Ą─蹊┐įĮüĒįĮę²Ų╚╦éāųžęĢĪŻ
Č■Īó蹊┐╦╝┬Ę+╝╝ąg(sh©┤)┬ĘŠĆ
Step 1 ║Y▀xĪ¬Ī¬Å─┼R┤▓śė▒Š│÷░l(f©Ī)Ż¼═©▀^Ė▀═©┴┐ąŠŲ¼║Y▀xĮY(ji©”)║ŽqPCR“×ūCĄ├ĄĮ─┐ś╦circRNAĪŻ
ū„š▀▀xō±┴╦7└²HCCĮM┐Ś╝░ŲõŽÓæ¬(y©®ng)Ą─š²│ŻĮM┐Śī”ššŻ¼ė├Ė▀═©┴┐circRNA microArray▀MąąĘų╬÷Ż¼║Y▀x│÷Ė╬╝Ü░¹░®ųą20éĆ▓Ņ«ÉūŅ×ķ’@ų°Ą─CircRNAū÷Š█ŅÉĘų╬÷Ī¬Ī¬Ųõųą░³└©10éĆcircRNA’@ų°╔Žš{(di©żo)Ż¼10éĆcircRNA’@ų°Ž┬š{(di©żo)Ż¼qPCR“×ūC┴╦▀@20éĆcircRNA┼cąŠŲ¼ĮY(ji©”)╣¹ę╗ų┬ĪŻ
Step 2 ĶbČ©Ī¬Ī¬Ķbäe▓ó┤_šJ─┐ś╦circRNAŻ¼▓óį┌Ė³┤¾┴┐┼R┤▓śė▒Šųą┤_šJŲš▒ķąį
ū„š▀ī”üĒį┤ė┌21éĆ▓Ī╚╦Ą─HCCśė▒Šųąī”╔Ž╩÷20éĆcircRNAsĄ─▒Ē▀_Ūķør▀Mąą┴╦“×ūCŻ¼┤_šJcircMTO1 Ż©has_circRNA_0007874/has_circRNA_104135Ż®į┌HCCĮM┐Śųą’@ų°Ž┬š{(di©żo)ĪŻ└^└m(x©┤)Ę┼┤¾śė▒Š┴┐Ż¼ĮY(ji©”)╣¹░l(f©Ī)¼F(xi©żn)ŽÓī”ė┌š²│ŻĖ╬ĮM┐ŚŻ¼circMTO1į┌87.4%Ż©228/261Ż®Ą─Ė╬░®ĮM┐Śųą▒Ē▀_’@ų°Ž┬ĮĄĪŻė├▀^ĮM┐ŚįŁ╬╗ļsĮ╗Ż©ISHŻ®Ą╚ĘĮĘ©▒Ē├„Ż¼HCCĮM┐ŚųącircMTO1▒Ē▀_įĮĄ═Ż¼HCC▓Ī╚╦Ą─ŅA║¾įĮ▓ŅŻ¼circMTO1┼cHCC▓Ī╚╦Ą─É║ąį│╠Č╚ŽÓĻP(gu©Īn)ĪŻ
▒M╣▄▀ĆėąÄūéĆ║“▀xcircRNAŻ©circARID1B, circFAM13B, ║═circFARP2Ż®į┌HCCśė▒Šųąę▓ėąŽ┬š{(di©żo)Ż¼Ą½╩Ū│┴─¼▀@ą®circRNAsī”HCC╝Ü░¹Ą─╔·ķLø]ėą├„’@Ą─ė░ĒæŻ¼Č°│┴─¼circMTO1Ģ■├„’@┤┘▀MHCC╝Ü░¹Ą─į÷ų│ĪŻ
Step 3 ▒Ē▀_Ęų╬÷
ė├ĮM┐ŚįŁ╬╗ļsĮ╗Ż©ISHŻ®Ą╚ĘĮĘ©Ęų╬÷116└²Ä¦ėą╔·┤µöĄ(sh©┤)ō■(j©┤)Ą─śė▒ŠŻ¼ĮY(ji©”)╣¹▒Ē├„Ż¼HCCĮM┐ŚųącircMTO1▒Ē▀_įĮĄ═Ż¼HCC▓Ī╚╦Ą─ŅA║¾įĮ▓ŅŻ¼circMTO1┼cHCC▓Ī╚╦Ą─É║ąį│╠Č╚ŽÓĻP(gu©Īn)ĪŻ
Step 4 ╣”─▄Ęų╬÷
▀^▒Ē▀_╗“Ū├│²īŹ“×▒Ē├„circMTO1Ģ■ė░ĒæĖ╬╝Ü░¹░®Ą─į÷ų│Ż¼¾wā╚(n©©i)īŹ“×ę▓ūCīŹ┴╦▀@ę╗ĮY(ji©”)╣¹ĪŻ
Step 5 ĘųūėÖCųŲĘų╬÷Ī¬Ī¬ęįcircRNAĄ─ceRNAÖCųŲ×ķ╗∙ĄA(ch©│)Ż¼ŅA£y▓ó║Y▀x│÷circRNAĮY(ji©”)║ŽĄ─miRNAŻ¼Öz£yŲõŽ┬ė╬░ą╗∙ę“Ż¼ī”ŲõĘųūėÖCųŲ▀Mąą╔Ņ╚ļ蹊┐
═©▀^MirandaŅA£ycircMTO1─▄ĮY(ji©”)║Ž99éĆmicroRNAĪŻ×ķ┴╦┤_Č©ĄĮĄū╩Ū──ą®miRNAs┐╔ęį┼ccircMTO1ĮY(ji©”)║ŽŻ¼ū„š▀ė├circMTO1╠ž«ÉąįĄ─╠Įßśī”▀@99éĆmiRNAs▀Mąą┴╦RIPŻ©RNA in vivo precipitationŻ®║Y▀xĪŻū„š▀ų°ųžĘų╬÷┴╦įńŪ░ł¾Ą└Ą─20éĆ┐╔ęįį┌HCCųąŲū„ė├Ą─miRNAsŻ¼ĮY(ji©”)╣¹░l(f©Ī)¼F(xi©żn)miR-9├„’@Ė╗╝»Ż¼Å─Č°┤_Č©circRNA┐╔ęį║═miR-9ĮY(ji©”)║ŽĪŻ
═©▀^FISHīŹ“×▒Ē├„Ż¼circMTO1┤_īŹ┐╔ęį┼cmiR-9į┌░¹┘|(zh©¼)ųą╣▓Č©╬╗Ż¼▒Ē├„circMTO1┤_īŹ┐╔ęį┼cmiR-9į┌░¹┘|(zh©¼)ųąĮY(ji©”)║ŽĪŻŪęHCCśė▒ŠųąĄ─╣▓Č©╬╗├„’@╔┘ė┌š²│ŻĮM┐ŚĪŻ
|
|
║¾└^蹊┐
蹊┐╚╦åTį┌HCC╝Ü░¹ųą│┴─¼circMTO1Ż¼ęį蹊┐circMTO1ī”HCC▀Mš╣Ą─ė░Ēæęį╝░┼cmiR-9Ą─ŽÓ╗źū„ė├ĪŻū„š▀Öz£y┴╦8éĆ╝Ü░¹ŽĄųącircMTO1║═miR-9Ą─▒Ē▀_ŪķørŻ¼ĮY(ji©”)╣¹░l(f©Ī)¼F(xi©żn)Ż¼SK-Hep1ŽÓ▒╚ųącircMTO1▒Ē▀_ūŅĄ═Ż¼miR-9▒Ē▀_ūŅĖ▀Ż¼QGY-7701╝Ü░¹ųąā╔ĘNRNAĄ─▒Ē▀_Č╝▀mųąŻ¼ HepG2║═SMMC-7721╝Ü░¹ųąĄ─circMTO1▒Ē▀_▌^Ė▀Ż¼Č°miR-9Ą─▒Ē▀_▌^Ą═ĪŻ
ę“┤╦Ż¼čąŠ┐╚╦åT▀xō±į┌HepG2║═SMMC-7721╝Ü░¹ųą│┴─¼circMTO1ĪŻū„š▀į┌circMTO1Ą─Įė┐┌╠ÄįO(sh©©)ėŗ┴╦siRNAŻ¼į┌HepG2║═SMMC-7721╝Ü░¹ųą▐D(zhu©Żn)╚ļsiRNA║¾═©▀^qPCR▀Mąą┴╦Öz£yŻ¼ĮY(ji©”)╣¹▒Ē├„│┴─¼circMTO1├„’@┤┘▀M┴╦╝Ü░¹į÷ų│Ż¼į÷ÅŖ┴╦╝Ü░¹Ą─ŪųęuŻ¼▓óŪę£p╔┘┴╦Ą“═÷ĪŻ┴Ē═Ōį┌HepG2║═SMMC-7721╝Ü░¹ųą▀^▒Ē▀_miR-9┼c│┴─¼circMTO1ą¦╣¹ŽÓ╦ŲĪŻ
蹊┐╚╦åT▀Ćśŗ(g©░u)Į©┴╦circMTO1Ą─▀^▒Ē▀_ŽĄĮy(t©»ng)Ż¼į┌SK-Hep1║═QGY-7701╝Ü░¹ųą▀^▒Ē▀_circMTO1Ż¼├„’@┤┘▀M┴╦╝Ü░¹Ą─Ą“═÷ĪŻ
蹊┐╚╦åT▀Ć░l(f©Ī)¼F(xi©żn)Ż¼▀^▒Ē▀_║═│┴─¼circMTO1Č╝▓╗Ģ■ė░ĒæmiR-9Ą─▒Ē▀_╦«ŲĮŻ¼▀@šf├„circMTO1╩Ū═©▀^Ī░║ŻŠd╬³ĖĮĪ▒üĒęųųŲmiR-9Ą─╣”─▄Ą─ĪŻ
×ķ┴╦▀Mę╗▓ĮūCīŹcircMTO1╩Ūʱ╩Ū═©▀^Ī░║ŻŠdĪ▒╬³ĖĮmiR-9üĒ░l(f©Ī)ō]┐╣─[┴÷Ą─ū„ė├Ą─Ż¼čąŠ┐╚╦åTÖz£y┴╦─[┴÷ęųųŲ╗∙ę“p21Ą─▒Ē▀_ŪķørŻ©p21ę▓╩ŪmiR-9Ą─░ą╗∙ę“Ż®Ż¼ĮY(ji©”)╣¹▒Ē├„Ż¼¤ošō╩Ū│┴─¼circMTO1▀Ć╩Ū▐D(zhu©Żn)╚ļmiR-9Ą─mimicsŻ¼į┌HCC╝Ü░¹ųąČ╝┐╔ęį├„’@£p╔┘p21Ą─mRNA║═Ą░░ū╦«ŲĮĪŻ▀^▒Ē▀_circMTO1ät┐╔ęįį÷╝ėp21Ą─mRNA║═Ą░░ū╦«ŲĮĪŻ▀@šf├„circMTO1┐╔─▄╩Ū═©▀^Ę└ų╣p21▒╗miR-9Ž┬š{(di©żo)üĒąą╩╣Ųõ┐╣─[┴÷ū„ė├Ą─ĪŻ
ĮėŽ┬üĒŻ¼čąŠ┐╚╦åTīŹ“×▒Ē├„Ż¼«ö╝ė╚ļmiR-9Ą─ęųųŲä®ĢrŻ¼p21Ą─mRNA║═Ą░░ū╦«ŲĮČ╝▓╗į┘▒╗Ž┬š{(di©żo)┴╦Ż¼circMTO1│┴─¼ę▓▓╗į┘┤┘▀M╝Ü░¹į÷ų│║═ęųųŲ╝Ü░¹Ą“═÷┴╦ĪŻ▀@┐╔ęįšf├„Ż¼╝ė╚ļmiR-9Ą─ęųųŲä®┐╔ęįūĶöÓ│┴─¼circMTO1Ą─ū„ė├ĪŻ
¾wā╚(n©©i)īŹ“×
ūŅ║¾ū„š▀ėųĮ©┴ó┴╦ę╗éĆHCCĄ─┬Ń╩¾─Żą═Ż©SMMC-LTNMŻ®Ż¼═©▀^╬▓ņo├}ūó╔õcircMTO1Ą─siRNAsŻ¼ā╔ų▄ų«║¾░l(f©Ī)¼F(xi©żn)Ż¼─[┴÷╔·ķL╝ė╦┘┴╦Ż¼č¬ŪÕųąAFPĄ─╦«ŲĮ├„’@į÷╝ėĪŻ╬▓ņo├}ūó╔õsiRNAs48h║¾SMMC-LTNMĄ──[┴÷ĮM┐ŚųącircMTO1║═p21Ą─▒Ē▀_╦«ŲĮ├„’@£p╔┘ĪŻ┴Ē═ŌŻ¼ā╚(n©©i)į┤ąįŪ├Ą═circMTO1ę▓Ģ■ęųųŲp21╝░ŲõŽ┬ė╬CDK2Ą─▒Ē▀_Ż¼Č°╝Ü░¹Ūųęu║═į÷ų│Ą─marker MMP2║═PCNAät╔Žš{(di©żo)ĪŻ▀@ą®öĄ(sh©┤)ō■(j©┤)▒Ē├„circMTO1┐╔ęįį┌¾wā╚(n©©i)ęųųŲHCCĄ─▀Mš╣ĪŻ
|
|
|
|
|
TipsĪ¬Ī¬čąŠ┐circRNAĄ─╦╝┬ĘŻ©üĒį┤Ż║ŠW(w©Żng)Įj(lu©░)Ż®
ę╗Īó║Y▀xcircRNAsĪŻ│Żė├ĘĮĘ©Ż║Ė▀═©┴┐ąŠŲ¼║Y▀xŻ¼RNA-seqĄ╚
Č■Īó“×ūC┼cĶbČ©circRNA+▒Ē▀_Ęų╬÷ĪŻ│Żė├ĘĮĘ©Ż║Q-PCRŻ¼F(xi©żn)ISHŻ¼NorthernĄ╚
circRNAĄ─RT-PCR“×ūC╠žäeų«╠ÄĪŻ
│ŻęÄ(gu©®)PCRę²╬’ų╗ßśī”─┐Ą─Ų¼Č╬Ą─╔ŽŽ┬ė╬▀MąąįO(sh©©)ėŗŻ¼Č°circRNAę²╬’┐╔ĘųęįŽ┬ā╔ĘNĘĮ╩ĮįO(sh©©)ėŗŻ║
1Ż®═Ō’@ūėŁh(hu©ón)╗»circRNAŻ¼ąĶę¬╠ž«Éąįßśī”╝¶Ūą╬╗³c╠ÄŻ©backsplice junction site)üĒįO(sh©©)ėŗprimerŻ╗
2Ż®ā╚(n©©i)║¼ūėŁh(hu©ón)╗»circRNAŻ¼┐╔┐ń╝¶Ūą╬╗³cįO(sh©©)ėŗŻ¼ę▓┐╔ć·└@ā╚(n©©i)║¼ūėģ^(q©▒)ė“įO(sh©©)ėŗę²╬’ĪŻ┴Ē═ŌŻ¼circRNAę²╬’įO(sh©©)ėŗĮ©ūh▀ĆąĶę¬ØMūŃöUį÷«a(ch©Żn)╬’ķLČ╚▓╗│¼▀^100bpŻ╗Ūęā╚(n©©i)ģó╗∙ę“▓╗─▄▀xė├ŠĆąįmRNAŻ¼┐╔▓╔ė├═ŌģóÅøčaĪŻ
circRNA▒Ē▀_Ą─ĮM┐Ś╠ž«Éąį“×ūCŻ║ė├įŁ╬╗ļsĮ╗╝╝ąg(sh©┤)Ż©Situ HybridizationŻ®▀Mąą“×ūCĪŻįO(sh©©)ėŗļsĮ╗╠ĮßśĢrę¬┐ńbacksplice junction╬╗³cŻ¼Č°║¾┐╔║▄ŪÕ│■Ą─┐┤ĄĮcircRNAį┌──ą®ĮM┐Śųą▒Ē▀_║▄Ė▀Ż¼ū„×ķĮM┐Ś╠žąį┼ąöÓĄ─ę└ō■(j©┤)ĪŻ╝Ü░¹Č©╬╗╩ŪøQČ©š{(di©żo)┐žÖCųŲ蹊┐ĘĮŽ“Ą─ĻP(gu©Īn)µIĪŻ
|
|
╚²ĪócircRNA╣”─▄Ęų╬÷│Żė├ĘĮĘ©Ż║š²Ž““×ūCĪ¬Ī¬circRNA▀^▒Ē▀_Ż╗Ę┤Ž““×ūCĪ¬Ī¬circRNA│┴─¼/Ū├│²
š²Ž““×ūCĪ¬Ī¬circRNA▀^▒Ē▀_
─┐Ū░▒╚▌^╣½šJĄ─│╔Łh(hu©ón)ÖCųŲ×ķcircRNAé╚(c©©)ęĒą“┴ąĄ─ēA╗∙╗źča┼õī”Ż¼ĘQų«×ķAluĮY(ji©”)śŗ(g©░u)ĪŻ╗∙ė┌┤╦Ż¼┐╔ė├PCRöUį÷║¼é╚(c©©)ęĒAluą“┴ąĄ──┐ś╦DNAą“┴ąŻ¼Č°║¾ę└ō■(j©┤)ŽÓæ¬(y©®ng)Ž▐ųŲąįā╚(n©©i)Ūą├Ė╬╗³c▀Mąą├ĖŪąŻ¼▀BĮėų┴pEGFP-C1▌d¾wųąĪŻīó▀BĮė▌d¾w▐D(zhu©Żn)╚ŠŽÓæ¬(y©®ng)╝Ü░¹śė▒ŠŻ¼Č©┴┐PCRÖz£y▐D(zhu©Żn)╚Šą¦┬╩ĪŻūŅ║¾ė├divergent primer“×ūCcircRNA▀^▒Ē▀_▒ČöĄ(sh©┤)ĪŻ
▀^▒Ē▀_▓▀┬įŻ║1.öUį÷─┐ś╦ģ^(q©▒)ė“░³║¼circRNAé╚(c©©)ęĒAluą“┴ą╗“ā╚(n©©i)▓┐ēA╗∙╗źčaą“┴ąŻ¼é╚(c©©)ęĒ╔ŽŽ┬ė╬1kb╠Ä▀^▒Ē▀_ą¦┬╩Ė³╝čŻ╗2.─┐ś╦ģ^(q©▒)ė“öUį÷╗∙ė┌╗∙ę“ĮMDNA×ķ─Ż░µĪŻ
|
Ę┤Ž““×ūCĪ¬Ī¬circRNA│┴─¼
│┴─¼circRNAŻ¼┐╔ė├siRNA│┴─¼Ż¼╝┤ßśī”circRNA Ą─backsplice junction╬╗³cŪ░║¾ą“┴ąįO(sh©©)ėŗsiRNAŻ╗Č°ī”ė┌ā╚(n©©i)║¼ūėŁh(hu©ón)╗»circRNAŻ¼▀Ć┐╔ßśī”ā╚(n©©i)║¼ūėģ^(q©▒)ė“įO(sh©©)ėŗŽÓæ¬(y©®ng)siRNAĪŻūŅ║¾└¹ė├Divergent primer“×ūCcircRNAŪ├│²▒ČöĄ(sh©┤)ĪŻ┤╦═ŌŻ¼├┐éĆsiRNAįO(sh©©)ėŗŽÓæ¬(y©®ng)Ą─ī”ššŻ©backsplice junction╬╗³cę╗Č╦╗źča┼õī”Ż¼┴Ēę╗Č╦Õe┼õ)ĪŻ |
╦─ĪócircRNAÖCųŲ蹊┐
─┐Ū░ßśī”circRNAĄ─╣”─▄ÖCųŲ蹊┐▓╗ČÓŻ¼Øōį┌Ą─š{(di©żo)┐ž╗∙ę“▒Ē▀_║═Ą░░ū║Ž│╔ĘĮ╩ĮėąŻ║
1Ż®circRNA┐╔ęįū„×ķĪ░spongeĪ▒║ŻŠd╬³miRNAŻ¼š{(di©żo)╣Ø(ji©”)░ą╗∙ę“Ż╗
2) circRNA─▄┼cĄ░░ū┘|(zh©¼)/RNAĮY(ji©”)║Ž,─╝╝»Ą░░ū┘|(zh©¼)Å═║Ž¾wĄ─ĮMĘų╗“š{(di©żo)┐ž╗∙ę“Ą─▒Ē▀_Ż╗
3Ż®circRNA═©▀^ēA╗∙╗źča┼õī”ų▒Įėš{(di©żo)┐žŲõ╦¹RNA╦«ŲĮĪŻ
ę╗░ŃüĒšfŻ¼ceRNAš{(di©żo)┐žÖCųŲ╩ŪcircRNAū„ė├ÖCųŲ蹊┐Ą─╩ū▀xŻ¼ę“Č°║▄ČÓ╬─š┬ā×(y©Łu)Ž╚Å─ceRNAĄ─ĮŪČ╚╚źĮŌßīŲõū„ė├ÖC└ĒĪŻČ°circRNAū„×ķmiRNAĄ─Ī░spongeĪ▒ėąā╔éĆ╗∙▒ŠŪ░╠߯║
1Ż®circRNA║═mRNAėą╣▓═¼Ą─miRNAĮY(ji©”)║Ž╬╗³cĪŻ
2Ż®circRNAė░ĒæŲõĖéĀÄĮY(ji©”)║Žī”Ž¾mRNAĄ─▒Ē▀_ĪŻ
╩ūŽ╚ė├RNA-FISH┤_šJcircRNAį┌╝Ü░¹ųąĄ─Č©╬╗ĪŻ╝Ü░¹Č©╬╗╩ŪøQČ©š{(di©żo)┐žÖCųŲ蹊┐ĘĮŽ“Ą─ĻP(gu©Īn)µIĪŻ▐D(zhu©Żn)õø║¾š{(di©żo)┐žė╚Ųõ╩ŪceRNAš{(di©żo)┐žŻ¼ę╗░ŃšJ×ķį┌╝Ü░¹┘|(zh©¼)ųą▀MąąŻ¼╚ń╣¹įōcircRNAų„ę¬Č©╬╗ė┌╝Ü░¹┘|(zh©¼)Ż¼─Ū├┤╩Ūėą┐╔─▄│╔×ķceRNAĘųūėĄ─ĪŻ
|
īżšę░ąČ©circRNAĄ─miRNA╝░miRNA░ąČ©Ą─mRNAĪŻ
1Ż®└¹ė├╔·╬’ą┼ŽóīWī”Ųõ▀MąąŅA£yŻ¼╝┤═©▀^miRcode/starBase║Y▀xcircRNAØōį┌Ą─miRNAĮY(ji©”)║Ž╬╗³cŻ©MREŻ®Ż¼═¼Ģr═©▀^miRTarBaseŅA£ymiRNAĄ─░ą╗∙ę“ĪŻČ°║¾ė├═©▀^¤╔╣Ō╦ž├Ėł¾ĖµŽĄĮy(t©»ng)╝░├Ōę▀╣▓│┴ĄĒŻ©RIPŻ®▀Mąą“×ūCcircRNA║═mRNAų«ķgĄ─▒Ē▀_│╩š²ŽÓĻP(gu©Īn)ąįĪŻ
2Ż®ę▓┐╔ų▒Įė═©▀^circRNA+mRNAĮM║ŽąŠŲ¼Ė▀═©┴┐║Y▀xŻ¼Ęų╬÷▓Ņ«É▒Ē▀_circRNA║═mRNAų«ķgĄ─▒Ē▀_ŽÓĻP(gu©Īn)ąįĘų╬÷Ż¼īżšę┼ccircRNAĻP(gu©Īn)ŽĄ├▄ŪąĄ─mRNAs |
|
ūŅ║¾Ż¼“×ūCcircRNAī”miRNA╝░ŲõŽ┬ė╬░ą╗∙ę“Ą─▒Ē▀_ė░ĒæĪŻ▀@▓┐Ęų┐╔═©▀^▀^▒Ē▀_║═│┴─¼circRNAųąÖz£ymRNAĄ─ūā╗»Ż¼▀^▒Ē▀_║═│┴─¼mRNAüĒÖz£ycircRNAĄ─ūā╗»ęį╝░circRNA║═mRNA▒Ē▀_ŽÓĻP(gu©Īn)ąįĘų╬÷╝ėęį“×ūCĪŻ
|
|
|
|
Ųõ╦³░Ė└²
|
▀@Ų¬Ņ}×ķĪ░CircNT5E acts as a sponge of microRNA-422a to promote glioblastoma tumorigenesis Ī▒Ą─╬─š┬Ż¼ī”GBMŽÓĻP(gu©Īn)Ą─ĘŪŠÄ┤aRNA▀Mąą┴╦╔Ņ╚ļ蹊┐Ż¼░l(f©Ī)¼F(xi©żn) circNT5E─▄ē“ū„×ķmiRNA-422aĄ─║ŻŠd╬³ĖĮ¾wŻ¼ęųųŲŲõ╗ŅąįŻ¼▀MČ°ė░Ēæ─z┘|(zh©¼)─Ė╝Ü░¹┴÷Ą──[┴÷░l(f©Ī)╔·ĪŻ
║Y▀xĘųūė
ū„š▀╩š╝»Ż│ī”┼R┤▓GBMśė▒ŠŻ¼▀MąąĖ▀═©┴┐Öz£yŻ¼ī”Ųõųą▓Ņ«É▒Ē▀_Ą─RNA▀Mąą╔·╬’ą┼ŽóīWĘų╬÷Ż¼╠¶▀x┴╦548éĆ▒Ē▀_╔Žš{(di©żo)Ą─circRNA/lncRNA▀Mąą▀Mę╗▓ĮĄ─蹊┐ĪŻ═©▀^TargetScanŅA£yŻ¼┤_Č©38éĆĖ▀Øōį┌Ą─miRNA-442a║ŻŠd╬³ĖĮ¾wŻ¼▓ó└¹ė├╔·╬’╦žś╦ėøĄ─miRNA pulldownīŹ“ׯ¼µiČ©┴╦─┐ś╦circRNAĪ¬hsa_circ_0077232 (circNT5E)ĪŻ
circNT5EĮķī¦Ą─GBM▒Ēą═蹊┐
į┌┤_Č©─┐ś╦║¾Ż¼Š═ę¬čąŠ┐ę╗Ž┬circNT5E╩Ū▓╗╩ŪĢ■ī”GBM▒Ēą═ėąė░ĒæŻ¼čąŠ┐š▀╩╣ė├FISHÖz£y┴╦š²│ŻŻ¼WHO IŻ¼WHO IIŻ¼WHO III║═WHO IV─z┘|(zh©¼)┴÷ĮM┐ŚųąĄ─circNT5EĪŻĮY(ji©”)╣¹’@╩ŠŻ¼ļSų°┼R┤▓ĘųŅÉĄ─į÷╝ėŻ¼circNT5EĄ─▒Ē▀_╦«ŲĮ’@ų°į÷╝ėŻ©Ž┬łDa-bŻ®ĪŻ
į┌┼õī”Ą─GBM─[┴÷ĮM┐ŚŻ©n = 18Ż®ųą▀MąąĄ─qRT-PCR£yČ©’@╩Š─[┴÷ĮM┐ŚųącircNT5E▒Ē▀_’@ų°Ė▀ė┌š²│ŻĮM┐ŚŻ©Ž┬łDcŻ®ĪŻ▀@ą®ĮY(ji©”)╣¹▒Ē├„circNT5Eį┌─z┘|(zh©¼)┴÷ųąŲų°ų┬░®╗∙ę“Ą─ū„ė├Ż¼Å─Č°┤┘╩╣╬ęéā蹊┐circNT5EĄ─╣”─▄ĪŻČ°║¾Öz▓ķ╝Ü░¹╗Ņ┴”Ż¼į÷ų│Ż¼Ą“═÷Ż¼Ūųęu║═▀węŲ─▄┴”ĪŻ
¾wā╚(n©©i)═ŌīŹ“×▒Ē├„Ż¼circNT5E▓╗āHī”GBM╝Ü░¹Ą─į÷ų│ĪóĄ“═÷Īó▀węŲ╝░Ūųęuėąę╗Č©Ą─ė░ĒæŻ¼▀Ć─▄ėąą¦┤┘▀M¾wā╚(n©©i)GBM─[┴÷Ą─ą╬│╔ĪŻ
circNT5E╚ń║╬ąą╩╣╣”─▄
┤_šJ▀^▒Ēą═Ż¼╩Ūė÷ęŖī”Ą─circRNAĪ½
蹊┐š▀ę¬ī”circNT5Eį┌GBMųą╚ń║╬ąą╩╣Ųõ╣”─▄▀MąąčąŠ┐ĪŻŠC║Ž┐╝æ]╔·╬’╦žś╦ėøĄ─miRNA pulldownīŹ“×ĮY(ji©”)╣¹Ż¼circNT5EĄ─ŠÄ┤a─▄┴”ęį╝░circNT5E┤¾┴┐ĘĆ(w©¦n)Č©┤µį┌ė┌GBM╝Ü░¹┘|(zh©¼)ųąĄ─╩┬īŹŻ¼čąŠ┐š▀▀xō±Å─ceRNAĄ─ĮŪČ╚üĒ▀Mąą╔Ņ╚ļĘų╬÷ĪŻ
蹊┐ĮY(ji©”)╣¹▒Ē├„Ż¼circNT5E┐╔ų▒ĮėĮY(ji©”)║ŽmiRNA-422aŻ¼ū„×ķŲõ║ŻŠd╬³ĖĮ¾wė░ĒæŽ┬ė╬░ą╗∙ę“Ą─▒Ē▀_ĪŻ
▀Mę╗▓ĮīŹ“×▒Ē├„Ż¼circNT5E─▄ē“═©▀^┼cmiRNA-422aĄ─ĮY(ji©”)║ŽŻ¼ĮŌ│²miRNA-422ī”ŲõŽ┬ė╬░ą╗∙ę“Ą─ęųųŲū„ė├Ż¼▀MČ°ė░ĒæGBM╝Ü░¹Ą─į÷ų│ĪóĄ“═÷Īó▀węŲ╝░ŪųęuĪŻ
蹊┐š▀└¹ė├Ė▀═©┴┐Ą─ĘĮĘ©║Y▀x┴╦GBMŽÓĻP(gu©Īn)Ą─ĘŪŠÄ┤aRNAŻ¼circNT5E┐╔═©▀^║ŻŠdĀŅ─z┘|(zh©¼)─Ė╝Ü░¹┴÷ęųųŲę“ūėmiRNA░l(f©Ī)ō]Ņ~═ŌĄ─š{(di©żo)╣Ø(ji©”)╣”─▄ĪŻ ▀@ą®ĮY(ji©”)╣¹×ķķ_░l(f©Ī)─z┘|(zh©¼)─Ė╝Ü░¹┴÷Ą─ą┬ą═ų╬»¤ĘĮĘ©╠ß╣®┴╦ęŌęŖĪŻ
|
|
Ą┌Č■└²Ż║PRMT5 Circular RNA Promotes Metastasis of Urothelial Carcinoma of the Bladder through Sponging miR-30c to Induce Epithelial©CMesenchymal Transition. Clinical Cancer Research. 2018circPRMT5═©▀^ceRNAÖCųŲšTī¦╔ŽŲżķg┘|(zh©¼)▐D(zhu©Żn)╗»Ż¼┤┘▀M░“ļū─“┬Ę╔ŽŲż░®▐D(zhu©Żn)ęŲ
|
ųą╔Į┤¾īW─[┴÷Ę└ų╬ųąą─ĖĮī┘─[┴÷ßt(y©®)į║ųxĄżšnŅ}ĮM└¹ė├Arraystar circRNA ąŠŲ¼čąŠ┐░l(f©Ī)¼F(xi©żn)į┌circPRMT5┼c░“ļū─“┬Ę╔ŽŲż░®Ż©UCBŻ®Ą─═ĒŲ┌▓Ī╚╦┼c╔·┤µ▌^▓ŅĄ─▓Ī╚╦ųą┤µį┌š²ŽÓĻP(gu©Īn)ĪŻČ°║¾╣”─▄蹊┐░l(f©Ī)¼F(xi©żn)circPRMT5┐╔ęį═©▀^╬³ĖĮmiR-30c┤┘▀MUCB╝Ü░¹Ą─╔ŽŲżķg┘|(zh©¼)▐D(zhu©Żn)╗»Ż©EMTŻ®ĪŻ┼R┤▓蹊┐░l(f©Ī)¼F(xi©żn)circPRMT5/miR-30c/SNAIL1/E-cadherin═©┬Ęī”ė┌UCBį÷ų│śOŲõųžę¬Ż¼Č°ŪęcircPRMT5į┌UCB┼R┤▓▓Ī╚╦Ą─č¬ŪÕ║══Ō├┌¾wųąČ╝╔Žš{(di©żo)▒Ē▀_ĪŻįō蹊┐│╔╣¹░l(f©Ī)▒Ēį┌īWąg(sh©┤)Ų┌┐»Clinical Cancer ResearchŻ©IF: 9.619Ż®ĪŻ
Ż©ąŠŲ¼īŹ“×ė╔┐Ą│╔╔·╬’╠ß╣®╝╝ąg(sh©┤)Ę■äš(w©┤)Ż® |
蹊┐▒│Š░Ż║
░“ļū─“┬Ę╔ŽŲż░®Š▀ėą▌^Ė▀Ą─░l(f©Ī)▓Ī┬╩Ż¼╩Ū╩└Įń╔ŽūŅ│ŻęŖĄ─É║ąį─[┴÷ų«ę╗ĪŻŲ∙Į±×ķų╣Ż¼▀Ćø]ėąßśī”UCB▐D(zhu©Żn)ęŲ╠žą¦╦ÄĪŻę“┤╦╔Ņ╚ļ蹊┐UCBĄ──[┴÷░l(f©Ī)╔·╝░▐D(zhu©Żn)ęŲĄ─ĘųūėÖCųŲŻ¼┐╔ęį×ķUCB┼R┤▓╗╝š▀╠ß╣®Ė³ėąą¦Ą─┐╣─[┴÷ų╬»¤ĘĮ╩ĮĪŻ
circRNA╩Ūę╗ŅÉ╣▓ārķ]║ŽĄ─Łh(hu©ón)ĀŅRNAŻ¼┐╔ęį═©▀^═Ō’@ūė╠°▄S║═Ę┤Ž“▀BĮėą╬│╔Łh(hu©ón)ĀŅRNAĪŻį┌▓╗═¼Ą─╔·└ĒŚl╝■Ž┬Ż¼Łh(hu©ón)ĀŅRNAĄ─▒Ē▀_Š▀ėąśOÅŖĄ─äėæB(t©żi)ąįĪŻĮ³üĒ蹊┐░l(f©Ī)¼F(xi©żn)Ż¼circRNA┐╔ęį═©▀^╬³ĖĮmiRNAģó┼cĄĮ─[┴÷Ą─░l(f©Ī)╔·▀^│╠Ż¼ę“┤╦circRNAę▓╩Ūę╗ŅÉėąŪ░Š░Ą──[┴÷į\öÓ║═ų╬»¤Ą─Ęųūėś╦ųŠ╬’ĪŻĄ½circRNA╩Ū╚ń║╬ģó┼c─[┴÷Ą─EMT▀^│╠Ż¼ŲõĘųūėÖCųŲ╚į▓╗×ķ╚╦ų¬ĪŻ
═Ō├┌¾w╩Ūę╗ŅÉÅ─╝Ü░¹ßīĘ┼ĄĮ░¹═Ō╬óŁh(hu©ón)Š│Ą─ų▒ÅĮį┌30-100nmų«ķgĄ─Š▀ėą─żĮY(ji©”)śŗ(g©░u)Ą─▒PĀŅąĪ─ę┼▌Ż¼Ųõā╚(n©©i)░³╣³ų°miRNAĪómRNA║═Ą░░ūŻ¼ąą±éų°░¹ķgą┼ŽóĮ╗┴„Ą─╣”─▄ĪŻūŅĮ³Ż¼ęčėą╬─š┬ūCīŹ─[┴÷╝Ü░¹┐╔ęįßīĘ┼░³║¼ų°circRNAĄ─═Ō├┌¾wĄĮč¬ŪÕųąŻ¼Ą½Ųõ▓Ī└ĒīW╣”─▄╚į╬┤ų¬ĪŻUCB▓Ī╚╦Ą─č¬ę║║═─“ę║ųą═Ō├┌¾wĄ─öĄ(sh©┤)┴┐ėą├„’@Ą─╔Ž╔²Ż¼čąŠ┐UCB▓Ī╚╦Ą─═Ō├┌¾w░³║¼Ą─circRNA╝░ŲõĘųūė╣”─▄Ż¼Š▀ėąųžę¬Ą─┼R┤▓ęŌ┴xĪŻ |
蹊┐╦╝┬ĘŻ║
╬─š┬ų°ųžė┌蹊┐circPRMT5į┌UCB┼R┤▓▓Ī╚╦ųąĄ─╣”─▄║═ÖCųŲ蹊┐ |
Step 1 ║Y▀x+Ķbäe+▒Ē▀_Ęų╬÷
ū„š▀▀\ė├Arraystar circRNAąŠŲ¼Öz£yUCBĄ──[┴÷ĮM┐Ś║═š²│ŻĮM┐ŚųącircRNAĄ─▒Ē▀_┴┐Ż¼═©▀^▓Ņ«É▒ČöĄ(sh©┤)ĪópųĄĪóFDRųĄ║Y▀xų«║¾Ż¼░l(f©Ī)¼F(xi©żn)circPRMT5Ą─▒Ē▀_┴┐į┌─[┴÷ĮM┐Śųą╔Žš{(di©żo)ūŅ├„’@ĪŻļS║¾Ż¼ū„š▀╩š╝»119ī”UCB─[┴÷ĮM┐Ś║═┼õī”Ą─š²│Ż░“ļūĮM┐ŚŻ¼═©▀^qPCR“×ūC┴╦circPRMT5į┌UCB─[┴÷ĮM┐ŚųąŲš▒ķ╔Žš{(di©żo)ĪŻ |
Step 2 ╣”─▄Ęų╬÷+ĘųūėÖCųŲ
×ķ┴╦蹊┐circPRMT5į┌UCBĮM┐ŚųąĄ─╣”─▄Ż¼ū„š▀śŗ(g©░u)Į©┴╦Ė▓╔wcircPRMT5Ę┤Ž“╝¶Ūą╬╗³cĄ─shRNAŻ¼ĮY(ji©”)╣¹’@╩ŠŪ├Ą═circPRMT5ų«║¾Ż¼├„’@ęųųŲUCB╝Ü░¹Ą─▀węŲ║═Ūųęu─▄┴”ĪŻ┴Ēę╗ĘĮ├µŻ¼▀^▒Ē▀_circPRMT5┐╔ęįį÷ÅŖUCB╝Ü░¹Ą─▀węŲ║═Ūųęu─▄┴”ĪŻäė╬’─Żą═’@╩ŠŻ¼═©▀^ąĪ╩¾╬▓ņo├}ūó╔õĘĆ(w©¦n)Č©Ū├Ą═circPRMT5Ą─T24╝Ü░¹ŽĄŻ©UCB╝Ü░¹ŽĄŻ®Ż¼ąĪ╩¾Ą─Ę╬▓┐▐D(zhu©Żn)ęŲįŅ’@ų°£p╔┘Ż╗ūó╔õ▀^▒Ē▀_circPRMT5Ą─╝Ü░¹ŽĄŻ¼Ę╬▓┐▐D(zhu©Żn)ęŲįŅ├„’@į÷╝ėĪŻ
ÖCųŲ蹊┐’@╩ŠŻ¼═©▀^AGO2 RIPīŹ“ׯ¼circPRMT5┐╔ęį┼cAGO2ĮY(ji©”)║ŽŻ¼▀M╚ļRISCÅ═║Ž╬’ĪŻļp¤╔╣Ō╦ž├Ėł¾ĖµŽĄĮy(t©»ng)’@╩ŠŻ¼circPRMT5┐╔ęįū„×ķmiR-30cĄ─╬³ĖĮ║ŻŠdĪŻ╩╣ė├╔·╬’ś╦ėøĄ─circPRMT5╠ĮßśŻ¼└Ł╚Ī┼ccircPRMT5ŽÓ╗źū„ė├Ą─miRNAŻ¼░l(f©Ī)¼F(xi©żn)miR-30c┐╔ęį▒╗Ė╗╝»ĪŻFIShīŹ“ד×ūCcircPRMT5┼cmiR-30cį┌╝Ü░¹ā╚(n©©i)┐╔ęį▒╗╣▓Č©╬╗Ż¼ę“┤╦ū„š▀╠¶▀xmiR-30cū„×ķcircPRMT5Ą─░ąś╦▀Mąą║¾└m(x©┤)蹊┐ĪŻ
║¾└m(x©┤)蹊┐ūCīŹŻ¼circPRMT5┤┘▀MUCB╝Ü░¹▀węŲ║═EMT╩Ū═©▀^╬³ĖĮmiR-30cŻ¼ĮĄĄ═miR-30cĄ─ęųųŲą¦æ¬(y©®ng)Ą─ĘĮ╩Įąą╩╣╣”─▄ĪŻČ°ŪęcircPRMT5═©▀^š{(di©żo)┐žmiR-30c/SNAIL1/E-cadherin═©┬ĘŻ¼▀MČ°┤┘▀MUCB╝Ü░¹Ą─EMT▀^│╠ĪŻūŅ║¾Ż¼ū„š▀╩š╝»┴╦š²│Ż╚╦┼cUCB▓Ī╚╦Ą─č¬ŪÕ║═─“ę║ųąĄ─═Ō├┌¾wŻ¼qPCRīŹ“×’@╩ŠÅ─UCB╗╝š▀Ą─č¬ŪÕ║═─“ę║ĘųļxĄ─═Ō├┌¾wųącircPRMT5Ą─▒Ē▀_┴┐Ė³Ė▀Ż¼miR-30cĄ─▒Ē▀_┌ģä▌Ż¼┼ccircPRMT5Ą─▒Ē▀_┌ģä▌│╩├„’@Ą─žōŽÓĻP(gu©Īn)ĪŻ |
蹊┐ęŌ┴xŻ║
▒ŠčąŠ┐▀\ė├Arraystar CircRNA ąŠŲ¼čąŠ┐░“ļū─“┬Ę╔ŽŲż░®Ż©UCBŻ®ĮM┐ŚųącircRNAĄ─▒Ē▀_║═╣”─▄ĪŻ░l(f©Ī)¼F(xi©żn)circPRMT5Ą─▒Ē▀_į┌UCBĮMųą’@ų°╔²Ė▀Ż¼▓óŪę┼cUCB▓Ī╚╦▓ŅĄ─ŅA║¾ŽÓĻP(gu©Īn)ĪŻ╣”─▄║═ÖCųŲ蹊┐░l(f©Ī)¼F(xi©żn)Ż¼circPRMT 5═©▀^║ŻŠd╬³ĖĮmiR-30cŻ¼š{(di©żo)┐žSNAIL/E-cadheriną┼╠¢═©┬ĘŻ¼┤┘▀MUCB╝Ü░¹ŽĄĄ─EMT═ŠÅĮ║═Ūųęu─▄┴”Ż¼ęŌ╬Čų°circPRMT5į┌UCBĄ─▐D(zhu©Żn)ęŲ▀^│╠ųąŲų°┤┘▀Mū„ė├ĪŻ▀Mę╗▓ĮŻ¼¾wā╚(n©©i)Ė╔ŅAcircPRMT5īŹ“×▒Ē├„circPRMT5╩Ūę╗éĆą┬Ą─įŁ░®Łh(hu©ón)ĀŅRNAĘųūėĪŻĮY(ji©”)╣¹▓╗āHāHĻUßī┴╦UCB▐D(zhu©Żn)ęŲĄ─ą┬ÖCųŲŻ¼ę▓▒Ē├„circPRMT5┐╔ū„×ķUCBų╬»¤Ą─░ąś╦ĪŻ
|
circRNA┼c╝▓▓Ī
Į³üĒ蹊┐ķ_╩╝ĻP(gu©Īn)ūóė┌circRNA┐╔─▄į┌╝▓▓Ī▓Ī└ĒĘĮ├µŲĄĮĄ─ū„ė├ĪŻ└²╚ńŻ¼Łh(hu©ón)ĀŅANRILŻ©cANRILŻ®╩ŪķLµ£ĘŪŠÄ┤aRNA ANRILĄ─Łh(hu©ón)ĀŅŲ┤Įėą╬╩ĮŻ¼Ųõį┌╚╦ŅÉ╝Ü░¹ųąĄ─▒Ē▀_┼cįō╬╗³c╔ŽÄūéĆ┐╔─▄ė░ĒæANRILŲ┤ĮėĄ─SNPėąĻP(gu©Īn)Ż¼─▄š{(di©żo)╣Ø(ji©”)INK4/ARFĄ─╦«ŲĮ▓óį÷╝ėäė├}ųÓśėė▓╗»Ą─’LļUĪŻ▀@ĒŚčąŠ┐│õĘųūC├„circRNA┼c╝▓▓ĪĄ─░l(f©Ī)╔·┤µį┌ĻP(gu©Īn)┬ō(li©ón)Ż¼▓ó─▄║▄║├Ąžū„×ķ╝▓▓Īą┬ą═╔·╬’ś╦ėøĪŻ
┤╦═ŌŻ¼Ė³ČÓĄ─ūCō■(j©┤)’@╩ŠŻ¼Łh(hu©ón)ĀŅRNAį┌miRNA╦«ŲĮĄ─╬óš{(di©żo)╔ŽŲų°ĘŪ│Żųžę¬Ą─ū„ė├Ż¼═©▀^ĖéĀÄĮY(ji©”)║ŽmiRNAüĒš{(di©żo)┐ž╗∙ę“Ą─▒Ē▀_ĪŻČ°┼c╝▓▓ĪĻP(gu©Īn)┬ō(li©ón)miRNAĄ─ŽÓ╗źū„ė├ätšf├„Łh(hu©ón)ĀŅRNA─▄ē“ģó┼c╝▓▓Īš{(di©żo)╣Ø(ji©”)ĪŻ┐╔ęįŅAęŖŻ¼ėąmiRNAĄ─ŅI(l©½ng)ė“Ż¼Š═┐╔─▄ėącircRNA╣”─▄Ą─蹊┐³cĪŻ═©▀^┼c╝▓▓ĪĻP(gu©Īn)┬ō(li©ón)Ą─miRNAŽÓ╗źū„ė├Ż¼circRNAį┌╝▓▓Īųą░l(f©Ī)ō]ų°──ą®š{(di©żo)┐žū„ė├Ż¼▒žīó¤ßķTĪŻį┘╝ė╔ŽcircRNAĘĆ(w©¦n)Č©▓╗ęūĮĄĮŌŻ¼╩Ūʱ─▄ū„×ķ╔·╬’ś╦ųŠ╬’Ż¼╩Ūʱ┐╔ė├ė┌į\öÓė├═ŠŻ¼ę▓▒ž╚╗╩Ū¤ßķTŅI(l©½ng)ė“ĪŻ└²╚ńŻ¼Łh(hu©ón)ĀŅRNA ciRS-7į┌╚╦─XĮM┐ŚųąžSĖ╗▒Ē▀_Ż¼┼c─X╠ž«ÉąįmicroRNA miR-7ŽÓ╗źū„ė├Ż╗Č°ciRS-7║¼ėąČÓéĆ┤«┬ō(li©ón)Ą─miR-7ĮY(ji©”)║Ž╬╗³cŻ¼ę“┤╦┐╔ęįū„×ķā╚(n©©i)į┤ąįĄ─miRNA║ŻŠdŻ¼ęųųŲmiR-7╗ŅąįĪŻ┐╝æ]ĄĮmiR-7╩ŪĖ„ĘN▓╗═¼░®░YŽÓĻP(gu©Īn)═©┬ĘĄ─ųžę¬š{(di©żo)╣Ø(ji©”)ę“ūėŻ¼═¼Ģrę▓ę“─▄ų▒Įėš{(di©żo)╣Ø(ji©”)a-═╗ė|║╦Ą░░ū║═Ę║╦žĄ░░ū▀BĮė├ĖAŻ©UBE2AŻ®Ą─▒Ē▀_Č°┐╔─▄┼c┼┴Į╔Ł║═░óŲØ║Ż─¼╝▓▓ĪĄ─░l(f©Ī)╔·ŽÓĻP(gu©Īn)Ż¼╦∙ęįciRS-7ę▓║▄ėą┐╔─▄ū„×ķ╔±Įø(j©®ng)ąįŽĄĮy(t©»ng)╝▓▓Ī║═░®░Y░l(f©Ī)╔·Ą─ųžę¬š{(di©żo)╣Ø(ji©”)ę“ūėĪŻ
|
░Ė└²š╣╩ŠŻ║
░Ė└²ę╗Ż║š¹║ŽĘų╬÷mRNA-miRNA-circRNA£yą“öĄ(sh©┤)ō■(j©┤)Įę╩Š╗»īW╬’ų┬░®ą┬ė^³c
|
▒ŠčąŠ┐ęį╚╦ŅÉHepG2╝Ü░¹×ķī”Ž¾Ż¼└¹ė├Ė▀═©┴┐£yą“╝╝ąg(sh©┤)Ęų╬÷BaPū„ė├▀^│╠ųąĄ─ų┬░®ÖCųŲĪŻš¹║ŽmRNAĪócircRNAĪómiRNA£yą“öĄ(sh©┤)ō■(j©┤)Ż©įO(sh©©)ų├6éĆĢrķg³cŻ®Ż¼Ģrą“Ęų╬÷Bap╠Ä└Ēī”╗∙ę“▒Ē▀_Ą─ė░ĒæĪŻĢrą“?q©▒)Ź“×░l(f©Ī)¼F(xi©żn)miR-181a-1_3pļSų°Ģrķgūā╗»▒Ē▀_ę╗ų▒Ž┬š{(di©żo)ĪŻū„š▀ęįŲõ×ķ蹊┐ī”Ž¾Ż¼īżšęį┌BaPū„ė├Ž┬Ą─š{(di©żo)┐žÖCųŲĪŻ░ą╗∙ę“ŅA£y░l(f©Ī)¼F(xi©żn)Ż¼ėą14éĆ▓Ņ«É▒Ē▀_mRNAŻ©░³└©DNAą▐Å═╗∙ę“MGMTŻ®║═16éĆ▓Ņ«É▒Ē▀_Ą─circRNAŠ▀ėąmiR-181a-1_3pĄ─ū„ė├╬╗³cĪŻöĄ(sh©┤)ō■(j©┤)Ęų╬÷░l(f©Ī)¼F(xi©żn)Ż¼ļSų°ĢrķgĄ─ūā╗»Ż¼miR-181a-1_3pĪóMGMT║═cirRNAŠ▀ėąę╗Č©Ą─▒Ē▀_ŽÓĻP(gu©Īn)ąįĪŻū„š▀═Ų£yŻ║į┌BaPū„ė├Ž┬Ż¼Ģ■│¼┴┐▒Ē▀_miR-181a-1_3pŻ¼Å─Č°ęųųŲMGMTĄ─ĘŁūgŻ¼ęųųŲDNAōpé¹ą▐Å═Ż╗ļSų°ĢrķgĄ─į÷╝ėŻ¼circRNAĄ─▒Ē▀_┴┐į÷╝ėŻ¼ĖéĀÄąįĮY(ji©”)║ŽmiR-181a-1_3pŻ¼Å─Č°ĮŌĘ┼MGMTŻ¼ę╗Č©│╠Č╚╔Žī”DNAōpé¹▀Mąąą▐Å═ĪŻ
|
|
miRNAŻ¼mRNA║═circRNAų«ķg═Ų£yĄ─ceRNAĖéĀÄĻP(gu©Īn)ŽĄ
|
░Ė└²Č■Ż║╔±Įø(j©®ng)Łh(hu©ón)ĀŅRNAį┌░l(f©Ī)ė²Ų┌ķgš{(di©żo)┐ž═╗ė|╣”─▄
ūŅĮ³Ż¼čąŠ┐╚╦åT▓╔ė├╚ź│²║╦╠Ū¾wĄ─RNA▀Mąą╔ŅČ╚£yą“Ż¼▓óĮY(ji©”)║Žėŗ╦Ń╣żŠ▀Ż¼ęčÅ─╣┼╔·Š·ĄĮ╚╦ŅÉĄ╚╔·╬’ųą░l(f©Ī)¼F(xi©żn)┴╦│╔Ū¦╔Ž╚fŚlą┬Ą─Łh(hu©ón)ĀŅRNAŻ©circRNAsŻ®ĪŻīŹ“×ūCīŹŻ¼ę╗ą®circRNAs┐╔ęįū„×ķĪ▒║ŻŠdĪ▒╬³ĖĮmiRNAsŻ¼Å─Č°ūĶų╣miRNAs┼cŲõ░ą╗∙ę“Ą─ŽÓ╗źū„ė├ĪŻcircRNAę▓┐╔ęį╬³ĖĮRNAĮY(ji©”)║ŽĄ░░ūŻ©RBPsŻ®Ż¼▀MČ°š{(di©żo)┐ž╝Ü░¹ā╚(n©©i)ŽÓĻP(gu©Īn)RBPs╗“RNAsĄ─▀\▌öĪŻ▒M╣▄į┌╔±Įø(j©®ng)į¬ųąęčĶbČ©ĄĮŲõ╦¹ĘNŅÉĄ─RNAŻ©╚ńmiRNAŻ¼lncRNAŻ®║═╗∙ė┌RNAĄ─š{(di©żo)┐ž─Ż╩ĮŻ¼Ą½ģs╔┘ėącircRNAsĄ─蹊┐ĪŻ
蹊┐░l(f©Ī)¼F(xi©żn)Ż¼circRNAs┤¾┴┐Ė╗╝»ė┌─XŻ¼üĒūįė┌ŠÄ┤a═╗ė|Ą░░ūĄ─╦▐ų„╗∙ę“Ż©łD1Ż®ĪŻĖ▀Ęų▒µ┬╩Ą─įŁ╬╗ļsĮ╗’@╩ŠŻ¼circRNAsų„ę¬╬╗ė┌╔±Įø(j©®ng)į¬śõ═╗Ż©łD2Ż®ĪŻīŹ“×ūCīŹ┴╦circRNAsį┌░l(f©Ī)ė²▀^│╠ųąš{(di©żo)┐ž═╗ė|╣”─▄Ż¼įSČÓcircRNAsĢ■į┌═╗ė|░l(f©Ī)╔·Ģr═╗╚╗ĄžĖ─ūā╦³éāĄ─žSČ╚Ż©łD3Ż®ĪŻ┤╦═ŌŻ¼į┌╔±Įø(j©®ng)╗Ņąįūį╔ĒĘĆ(w©¦n)æB(t©żi)Ž┬ĮĄ║¾Ż¼įSČÓcircRNAs▒Ē¼F(xi©żn)│÷├„’@Ą─╔Žš{(di©żo)╗“Ž┬š{(di©żo)Ż©łD4Ż®ĪŻį┌▒ŠčąŠ┐ųąŻ¼╬┤░l(f©Ī)¼F(xi©żn)─XcircRNAs┐╔ęįĮY(ji©”)║ŽmiRNAs║═RBPsŻ¼╗“╩ŪĘŁūg│÷Ą░░ūĪŻ
|
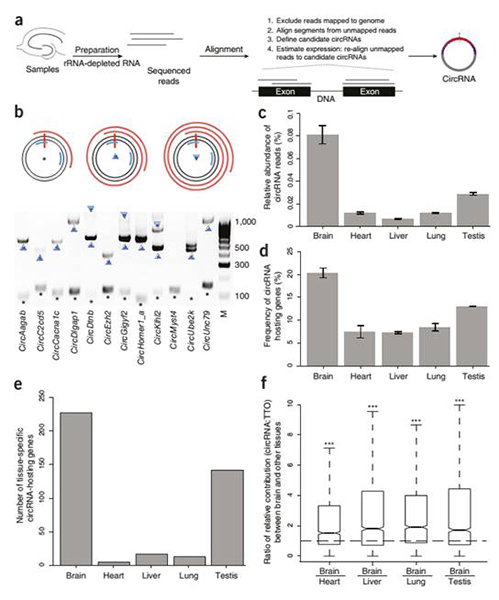
▓╗═¼ĮM┐ŚųąĄ─circRNAs▒Ē▀_ūVŻ¼Įę╩ŠcircRNAsĖ╗╝»ė┌─X
a. īŹ“×┼cĘų╬÷┴„│╠Ż¼b. circRNAsĄ─ą²▐D(zhu©Żn)Łh(hu©ón)ą╬cDNA«a(ch©Żn)╬’Ż¼c. ▓╗═¼ĮM┐ŚųąŁh(hu©ón)ą╬£yą“öĄ(sh©┤)ō■(j©┤)š╝┐╔▒╚ī”╗∙ę“ĮMĄ─£yą“öĄ(sh©┤)ō■(j©┤)Ą─▒╚└²Ż¼d. ▓╗═¼ĮM┐Śųą«a(ch©Żn)╔·circRNAsĄ─╗∙ę“š╝╦∙ėą▒Ē▀_╗∙ę“Ą─▒╚└²Ż¼e. ▓╗═¼ĮM┐Śųąų╗į┌ę╗ĘNĮM┐Śųą▒Ē▀_Ą─circRNA╦▐ų„╗∙ę“Ą─öĄ(sh©┤)┴┐Ż¼f. ─XŽÓ▒╚ė┌Ųõ╦¹ĮM┐ŚŻ¼╦▐ų„╗∙ę“╬╗³c╔ŽcircRNAs┼c┐é▐D(zhu©Żn)õø╬’Ą─žSČ╚▒╚└²ĪŻ
|
|
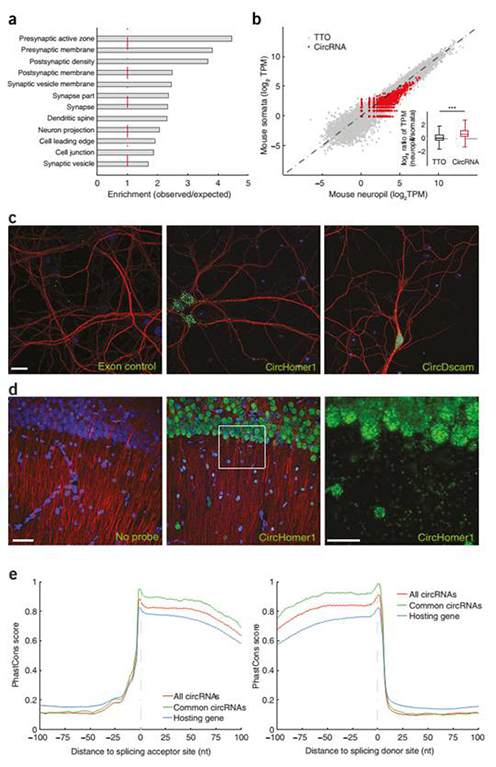
─X▒Ē▀_Ą─circRNAsüĒūįŠÄ┤a═╗ė|Ą░░ūĄ─╗∙ę“▓óĖ╗╝»ė┌═╗ė|ĮM┐Ś
|
|
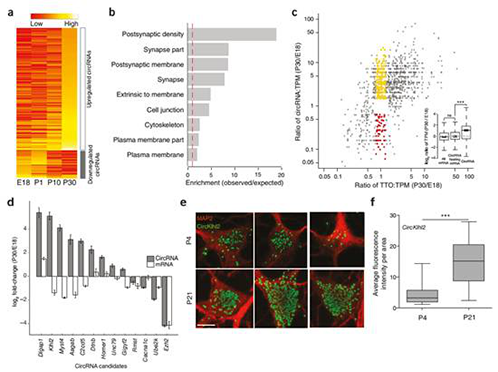
─XcircRNAsį┌░l(f©Ī)ė²▀^│╠ųąĄ─▒Ē▀_ūVūā╗»
|
|
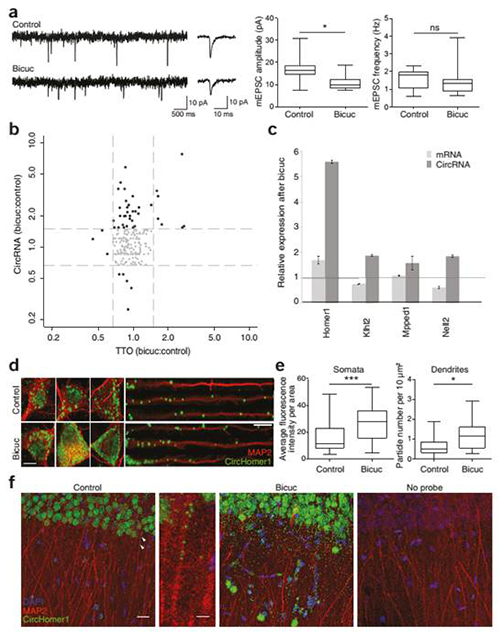
circRNAs╩▄ĄĮūį╔ĒĘĆ(w©¦n)æB(t©żi)┐╔╦▄ąįĄ─š{(di©żo)┐ž
|
|
░Ė└²╚²Ż║ĶbČ©ų▓╬’ųąÅVĘ║┤µį┌Ą─ĘŪŠÄ┤aŁh(hu©ón)ĀŅRNA
▒ŠčąŠ┐ęį╦«ĄŠ║═öM─ŽĮµ×ķ蹊┐ī”Ž¾Ż¼▀Mąą┴╦╚½╗∙ę“ĮMĘČć·circRNAĄ─ĶbČ©Ż¼▓óī”Ųõ╠žąį▀Mąą┴╦Ęų╬÷ĪŻ═©▀^ī”╦«ĄŠ║═öM─ŽĮµĄ─RNA seqöĄ(sh©┤)ō■(j©┤)▀Mąąģó┐╝╗∙ę“ĮM▒╚ī”║═▀^×VŻ¼┼ąöÓįŁ╩╝reads╩Ūʱ┤µį┌circRNA splicingŻ¼ūŅ║¾į┌╦«ĄŠųąĶbČ©ĄĮ12,037éĆcircRNAŻ¼į┌öM─ŽĮµųąĶbČ©ĄĮ6,012éĆcircRNAĪŻöĄ(sh©┤)ō■(j©┤)Ęų╬÷░l(f©Ī)¼F(xi©żn)Ż¼ėą700éĆ═Ō’@ūėcircRNAĄ─ėH▒Š╗∙ę“į┌╦«ĄŠ║═öM─ŽĮµųą×ķų▒ŽĄ═¼į┤╗∙ę“Ż¼▒Ē├„ų▓╬’ųąĄ─circRNAŠ▀ėą▌^ÅŖĄ─▒Ż╩žąįĪŻų▓╬’circRNA▒Ē¼F(xi©żn)│÷▓╗═¼Ą─▒Ē▀_─Ż╩ĮŻ¼27éĆ═Ō’@ūėcircRNAsį┌┴ū╦ß¹}├{Ų╚Ž┬│÷¼F(xi©żn)▓Ņ«É▒Ē▀_ĪŻ═¼Ģr░l(f©Ī)¼F(xi©żn)Ż¼ę╗ą®circRNA┼cėH▒Š╗∙ę“Ą─▒Ē▀_ūV▒Ē¼F(xi©żn)│÷’@ų°š²ŽÓĻP(gu©Īn)ĪŻ
|
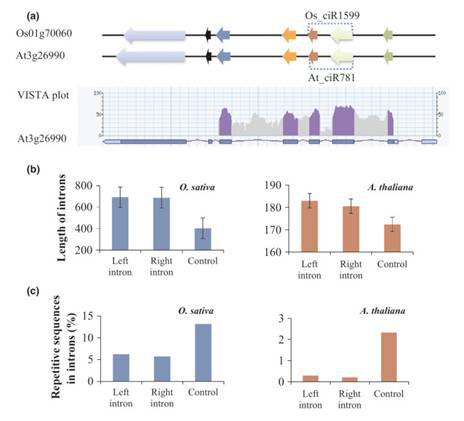
ų▓╬’Łh(hu©ón)ĀŅRNA╠žš„
|
|
|
circRNAĄ─Ė▀═©┴┐║Y▀x╝░“×ūC
|
Arraystar circRNAąŠŲ¼
ūŅą┬░µ▒Š╚╦V2.0ĪóąĪ╩¾V2.0Īó┤¾╩¾V2.0ĪŻÅ─circRNA蹊┐ŅI(l©½ng)ė“Ēö╝ŌŲ┌┐»║═ÖÓ(qu©ón)═■╣½╣▓öĄ(sh©┤)ō■(j©┤)Äņųą╩šõøūŅ┐╔┐┐Ą─circRNAĪŻ╝¶Ūą╬╗³c╠ž«Éąį╠Įßś┼cRnaseRŅA╠Ä└Ēļpųž▒ŻšŽŻ¼╠ž«ÉąįÖz£ycircRNAĪŻĮY(ji©”)╣¹ūóßīįö╝ÜŻ¼╠ß╣®circRNA┐╔─▄ĮY(ji©”)║ŽĄ─miRNAęį╝░ī”æ¬(y©®ng)host gene╝░ŠĆąįRNAŻ¼▒Ńė┌Å─▓╗═¼ĮŪČ╚蹊┐circRNAÖCųŲĪŻ
|
|
circRNA qRT-PCR
┐Ą│╔╔·╬’▓╔ė├ļSÖCę²╬’▀MąąĘ┤▐D(zhu©Żn)õøŻ¼ßśī”circRNA╠ž«ÉĄ─back splicing siteā╔é╚(c©©)ą“┴ą▀Mąąę²╬’(divergent primer)įO(sh©©)ėŗŻ¼įōę²╬’▓╗╩▄ŽÓæ¬(y©®ng)ŠĆąįRNAĘųūėĄ─ė░ĒæŻ¼ų╗Ģ■ī”─┐ś╦circRNA▀Mąą╠ž«ÉąįöUį÷Ż¼īŹ¼F(xi©żn)ī”circRNAĄ─▒Ē▀_Ą─¾{ą¦Īóņ`├¶Īó£╩┤_╝░╠ž«ÉąįĄžÖz£yĪŻ
|
| ę╗šŠ╩ĮĘ■äš(w©┤)┴╦ĮŌę╗Ž┬ >> |
|
Łh(hu©ón)ĀŅRNAĄ─╣”─▄“×ūCĘĮĘ©
|
circRNAČ©┴┐“×ūC
circRNAČ©┴┐“×ūC╩ųČ╬┼c│ŻęÄ(gu©®)PCR╩ųČ╬▓╗═¼Ż¼│ŻęÄ(gu©®)╩ųČ╬╩Ūć·└@─┐Ą─Ų¼Č╬Ą─╔ŽŽ┬ė╬ĘųäeįO(sh©©)ėŗPCRę²╬’Ż¼ĘQų«×ķconvergent primerŻ¼ąĶöUį÷Ą─Ų¼Č╬╬╗ė┌╔ŽŽ┬ė╬ę²╬’ų«ķgŻ©╚ńłD1.1Ż®ĪŻČ°ī”ė┌circRNAŻ¼ė╚Ųõ═Ō’@ūėŁh(hu©ón)╗»circRNAŻ¼│²backsplice junction╬╗³c╠Ä▓╗═¼ė┌linear RNAų«═ŌŻ¼bodyģ^(q©▒)┼clinearRNA╩Ūę╗ų┬Ą─ĪŻę“┤╦Ż¼“×ūCĢrąĶę¬╠ž«Éąįßśī”backsplice junction╬╗³c╠ÄįO(sh©©)ėŗprimerŻ¼ĘQų«×ķdivergent primerŻ©╚ńłDŻ®Ż¼Č°ŪęįO(sh©©)ėŗĄ─PCR productĄ─ķLČ╚įĮČ╠įĮ║├Ż¼┐╔ęįį÷ÅŖbacksplice junction╬╗³c╠ÄöUį÷ą¦┬╩ĪŻ
|
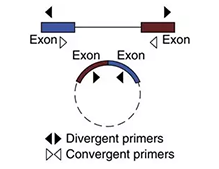
łD1 convergent primer vs divergent primer
|
|
×ķį÷ÅŖcircRNAĄ─“×ūCą¦┬╩Ż¼Ų╩╝─Ż░µąĶØMūŃęįŽ┬ę¬Ū¾Ż©3 freeŻ®Ż║1. DNA freeŻ╗2. rRNA freeŻ╗3. linearRNA freeĪŻ
“×ūC▓▀┬įŻ║ī”3free RNAęį╝░genome DNA═¼Ģr▀MąąPCRöUį÷Ż¼ļŖėŠÖz£yPCR product┤¾ąĪŻ©╚ńłDŻ®ĪŻ
|
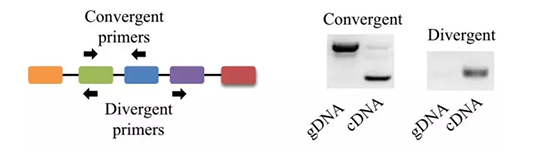
łD2 circRNAę²╬’öUį÷ĮY(ji©”)╣¹
|
|
circRNAČ©╬╗
╬╗ų├øQČ©╣”─▄ĪŻ╬╗ė┌╝Ü░¹║╦ųąĄ─circRNA┐╔─▄ų„꬚{(di©żo)┐žėH▒Š╗∙ę“Ą─▐D(zhu©Żn)õøŻ¼Č°╬╗ė┌╝Ü░¹┘|(zh©¼)ųąĄ─circRNA┐╔─▄ų„ę¬░l(f©Ī)ō]ĖéĀÄąįā╚(n©©i)į┤RNAĪ¬ceRNAĄ─ū„ė├ĪŻė├FISH(fluorescence in situ hybridization)¤╔╣ŌįŁ╬╗ļsĮ╗╝╝ąg(sh©┤)üĒ▀MąąČ©╬╗Ęų╬÷Ż¼┐╔ė^▓ņĄĮcircRNAį┌──ą®ĮM┐Śųą▒Ē▀_Ż¼ū„×ķĮM┐Ś╠žąį┼ąöÓĄ─ę└ō■(j©┤)ĪŻ╠ĮßśįO(sh©©)ėŗĢrąĶ┐ńįĮbacksplice junction╬╗³cģ^(q©▒)ė“ĪŻ
|
|
circRNA Northern blot“×ūC
Northern blotĘĮĘ©╩Ūę╗ĘN▒╚▌^╣┼└ŽĄ½ąąų«ėąą¦Ą─ą“┴ą“×ūCĘĮĘ©Ż¼ąĶć·└@circRNAįO(sh©©)ėŗ╠Įßśą“┴ąŻ¼Č°╠Įßśą“┴ąįO(sh©©)ėŗ╩Ū“×ūC│╔╣”ų┴ĻP(gu©Īn)ųžę¬Ą─Łh(hu©ón)╣Ø(ji©”)ĪŻī”ė┌circRNA╠ĮßśįO(sh©©)ėŗŻ¼╬ęéāĮ©ūhęįŽ┬ā╔³cŻ║1. ī”ė┌═Ō’@ūėŁh(hu©ón)╗»circRNAŻ¼Į©ūh╠Įßś▒M┐╔─▄┐ńbacksplice junction╬╗³cŻ╗2.ī”ā╚(n©©i)║¼ūėŁh(hu©ón)╗»circRNAŻ¼┐╔ć·└@ā╚(n©©i)║¼ūėģ^(q©▒)ė“įO(sh©©)ėŗ╠ĮßśĪŻ
“×ūC▓▀┬įŻ║ī”3 free RNAĪótotal RNAęį╝░genome DNA═¼Ģr▀MąąļsĮ╗“×ūCĪŻ
|
|
circRNA▀^▒Ē▀_
circRNA▀^▒Ē▀_╦╝Žļų„ę¬į┤ė┌circRNA╔·╬’ą╬│╔ÖCųŲŻ¼ęčėąČÓŲ¬╬─š┬ł¾Ą└circRNA│╔Łh(hu©ón)ÖCųŲŻ¼─┐Ū░▒╚▌^╣½šJĄ─│╔Łh(hu©ón)ÖCųŲ×ķcircRNAé╚(c©©)ęĒą“┴ąĄ─ēA╗∙╗źča┼õī”Ż¼ĘQų«×ķAluĮY(ji©”)śŗ(g©░u)Ż©╚ńłDŻ®ĪŻ
|
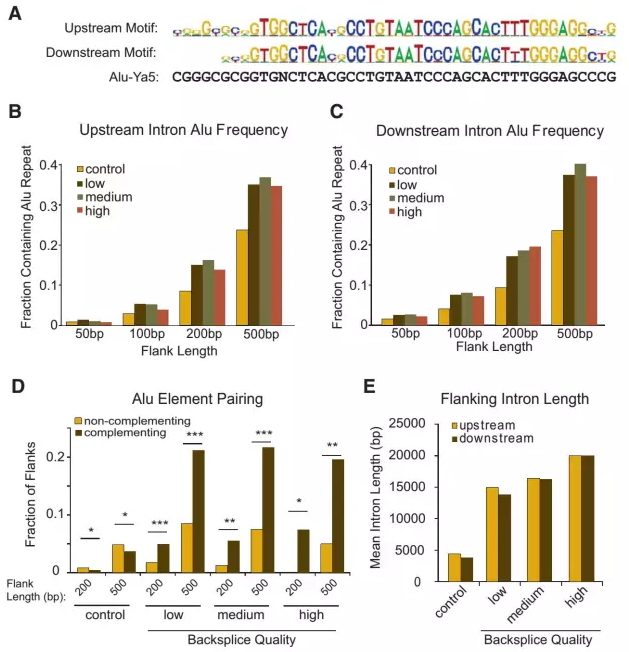
łD3 circRNAé╚(c©©)ęĒĮY(ji©”)śŗ(g©░u)╠žš„
╗∙ė┌circRNAé╚(c©©)ęĒAluą“┴ą╠žš„Ż¼PCRöUį÷║¼é╚(c©©)ęĒAluą“┴ąĄ──┐ś╦DNAą“┴ąŻ¼ļS║¾ę└ō■(j©┤)ī”æ¬(y©®ng)Ž▐ųŲąįā╚(n©©i)Ūą├Ė╬╗³c▀Mąą├ĖŪąŻ¼▀MČ°▀BĮėpEGFP-C1▌d¾wĪŻ▀BĮė▌d¾w▀MČ°▐D(zhu©Żn)╚Šī”æ¬(y©®ng)╝Ü░¹śė▒ŠŻ¼Č©┴┐PCRÖz£y▐D(zhu©Żn)╚Šą¦┬╩ĪŻ╗∙ė┌divergent primer“×ūCcircRNA▀^▒Ē▀_▒ČöĄ(sh©┤)ĪŻ
▀^▒Ē▀_▓▀┬įŻ║
1. öUį÷─┐ś╦ģ^(q©▒)ė“░³║¼circRNAé╚(c©©)ęĒAluą“┴ą╗“ā╚(n©©i)▓┐ēA╗∙╗źčaą“┴ąŻ¼é╚(c©©)ęĒ╔ŽŽ┬ė╬1kb╠Ä▀^▒Ē▀_ą¦┬╩Ė³╝čŻ╗
2. ─┐ś╦ģ^(q©▒)ė“öUį÷╗∙ė┌╗∙ę“ĮMDNA×ķ─Ż░µĪŻ
circRNAŪ├│²
circRNAŪ├│²╦╝┬Ęų„ę¬ßśī”circRNA backsplice junction╠Äą“┴ąą┼ŽóįO(sh©©)ėŗsiRNAŻ¼ī”ė┌ā╚(n©©i)║¼ūėŁh(hu©ón)╗»circRNAŻ¼ę▓┐╔ßśī”ā╚(n©©i)║¼ūėģ^(q©▒)ė“įO(sh©©)ėŗŽÓæ¬(y©®ng)siRNA▀MąąĖ╔ö_ĪŻDivergent primer“×ūCcircRNAŪ├│²▒ČöĄ(sh©┤)ĪŻ
Ū├│²▓▀┬įŻ║
1Īó═Ō’@ūėŁh(hu©ón)╗»circRNAŻ¼ßśī”backsplice junction╬╗³cŪ░║¾ą“┴ąįO(sh©©)ėŗsiRNAŻ¼╚ńłD╦∙╩ŠŻ╗
2Īóā╚(n©©i)║¼ūėŁh(hu©ón)╗»circRNAŻ¼│²ßśī”backsplice junction╬╗³cŪ░║¾ą“┴ąįO(sh©©)ėŗsiRNAą“┴ąęį═ŌŻ¼ę▓┐╔ßśī”ā╚(n©©i)║¼ūėģ^(q©▒)ė“ą“┴ąįO(sh©©)ėŗsiRNAĪŻ
3Īó├┐éĆsiRNAįO(sh©©)ėŗī”æ¬(y©®ng)Ą─ī”ššŻ¼backsplice junction╬╗³cę╗Č╦╗źča┼õī”Ż¼┴Ēę╗Č╦Õe┼õŻ¼╚ńłD3╦∙╩ŠĪŻ
łD4╗∙ė┌siRNAŪ├│²▓▀┬į
circRNAöĄ(sh©┤)ō■(j©┤)Äņ
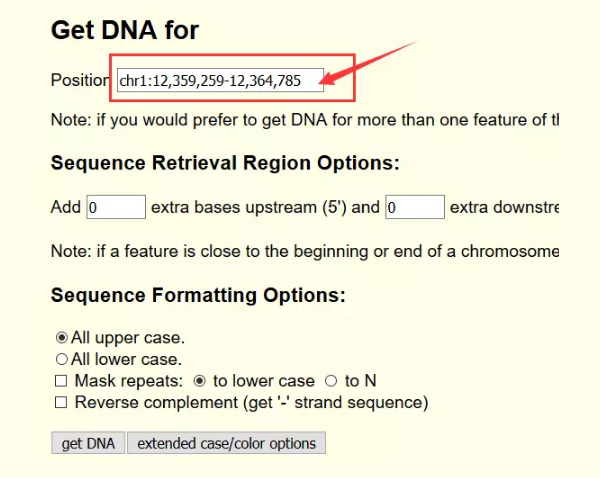
circbase
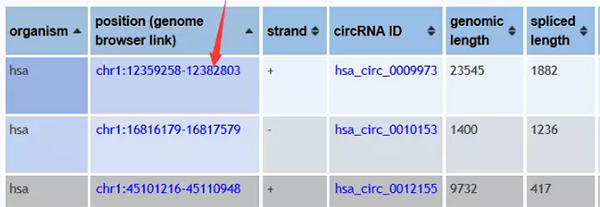
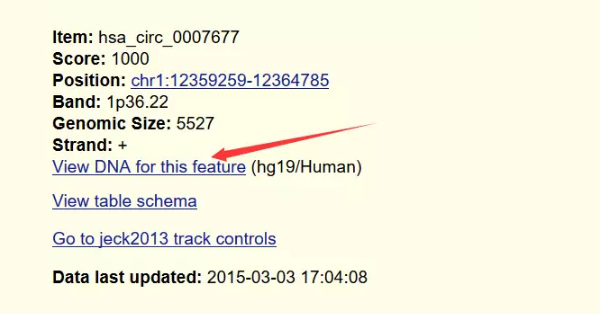
į┌circBaseŻ©http://www.circbase.org/cgi-bin/listsearch.cgiŻ®ųąŻ¼╬ęéā┐╔ęį═©▀^circRNA├¹ĘQŻ©hsa_circ_0010153Ż®Ż¼▐D(zhu©Żn)õø▒Š├¹ĘQŻ©NM_133494Ż®Ż¼╚Š╔½¾wČ©╬╗Ż©chr1:12359258-12382803Ż®Öz╦„circRNAĄ─ą┼ŽóŻ©ą“┴ąŻ¼Č©╬╗Ż¼gene_symbolĄ╚ą┼ŽóŻ®Ż¼─Ńę▓┐╔ęįų▒ĮėÖz╦„mRNAŽÓĻP(gu©Īn)Ż©TP53Ż®╗“╩Ū╔·╬’īW▀^│╠ŽÓĻP(gu©Īn)Ż©apoptosisŻ®Ą─circRNAĪŻ
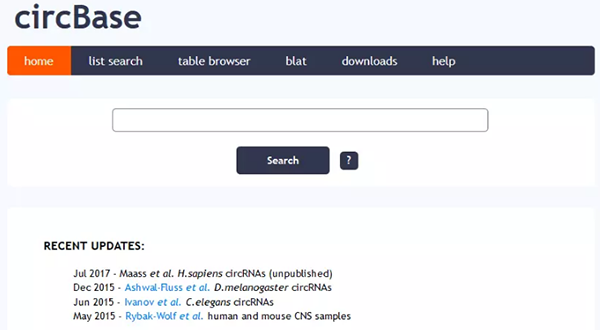
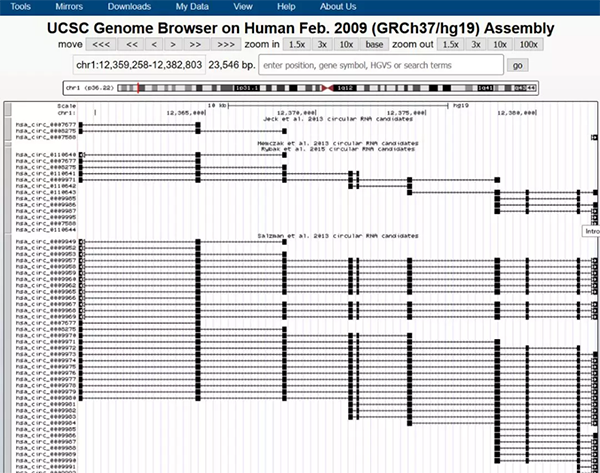
circBaseėąblat╣”─▄┐╔ęį▀Mąąą“┴ą▒╚ī”Ż¼ė├ė┌┴╦ĮŌ╗∙ę“Ą─╬’ĘN▒Ż╩žąįŻ¼▓╗▀^╬’ĘN▌^╔┘
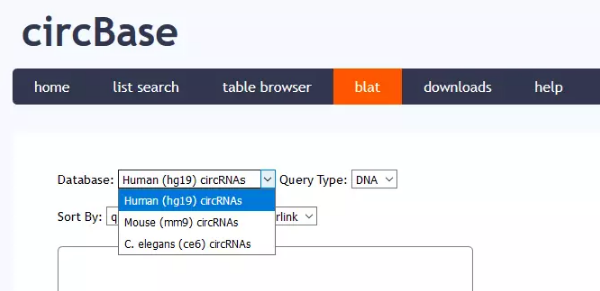
═Ų╦]╩╣ė├UCSCŻ©http://genome.ucsc.edu/Ż®Ą─blat╣”─▄
ŲõīŹcircBaseĄ─ą“┴ąą┼Žó▀Ć╩Ūį┤ė┌UCSC
Ą½╩Ūį┌UCSCųąų▒Įėė├hsa_circ_0010153ų▒Įė╦čŻ¼▀ĆŲ½Ų½╦č▓╗│÷Ž┬├µ▀@śėĄ─ĮY(ji©”)╣¹
³cķ_ę╗Ślą“┴ąŻ¼╝┤┐╔½@╚ĪįōŚlą“┴ąĄ─ą┼Žó
Ū░├µį┌circBaseųąŻ¼╬ęéāęčĮø(j©®ng)½@╚Ī┴╦circRNAĄ─╬╗ų├ą┼Žó┴╦Ż¼╦∙ęįŠ═▓╗ąĶę¬į┘ę╗éĆéĆ³cķ_▓ķ┐┤╗∙ę“ą“┴ą┴╦Ż¼ų▒Įėį┌UCSCųą▌ö╚ļ╬╗ų├ą┼Žó╝┤┐╔½@Ą├═Ļš¹Ą─╗∙ę“ą“┴ąĪŻ
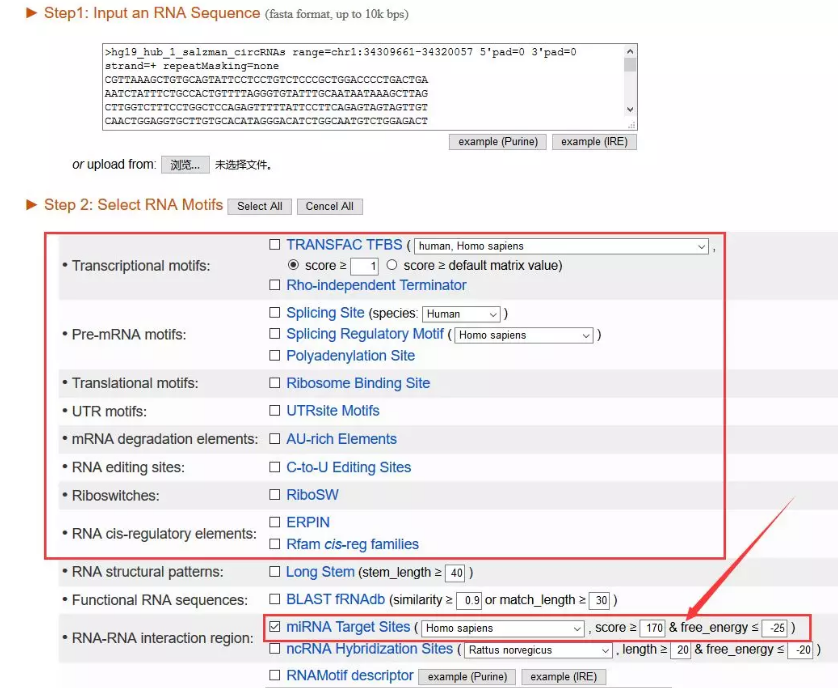
RegRNA2.0
─Ū╬ęéā½@╚Ī┴╦╗∙ę“ą“┴ą┐╔ęįĖ╔┬’─žŻ┐Ą┌ę╗Ę┤æ¬(y©®ng)«ö╚╗╩ŪŅA£ymiRNA┐®~
į┌RegRNA 2.0Ż©http://regrna2.mbc.nctu.edu.tw/Ż®ųąŻ¼╬ęéā┐╔ęįė├╗∙ę“ą“┴ąū÷║▄ČÓ╩┬ŪķŻ¼«ö╚╗ę▓░³└©ŅA£ymiRNAĪŻ
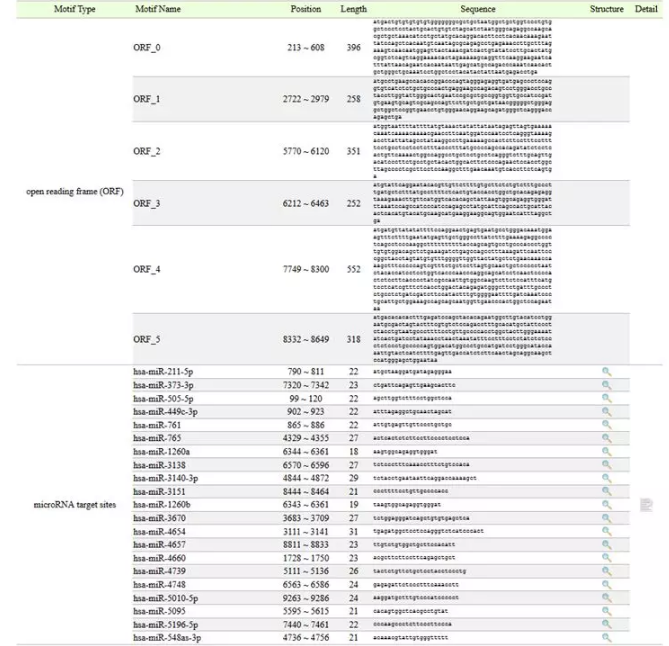
miRNAŅA£yĮY(ji©”)╣¹╚ńŽ┬

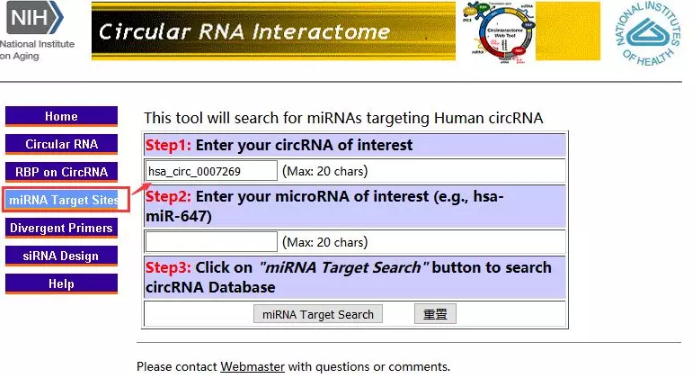
circlnteractome
Žė╔Ž├µ▀@éĆŅA£ycircRNAĄ─miRNA╠½┬ķ¤®Ż┐─Ū─Ń┐╔ęįįćįćCircInteractomeŻ©https://circinteractome.nia.nih.gov/Ż®
Š═╩Ū▀@├┤║åå╬┤ų▒®
ęį╔ŽĄ─Öz╦„ĮY(ji©”)╣¹╚ń╣¹Č╝▓╗─▄ūī─ŃØMęŌŻ¼─Ń┐╔ęįįćįćŪ·ŠĆŠ╚ć°Ą─ĘĮ╩ĮŻ¼ė├circRNAĄ─gene sybmolüĒ╦č╦„ŽÓĻP(gu©Īn)Ą─miRNAŻ¼▒╚╚ńhsa_circ_0009973Ą─gens symbol╩ŪVPS13DĪŻ▓╗▀^▀@śėę╗üĒ─ŃĄ├┤_šJcircRNA┼cmiRNAĮY(ji©”)║Žģ^(q©▒)ė“į┌mRNA║═circRNAą“┴ąųąČ╝╩Ū┤µį┌Ą─Ż¼╚ń╣¹ĮY(ji©”)║Žģ^(q©▒)ė“ė╔ė┌╝¶ŪąĘĮ╩Į▓╗═¼į┌circRNAųą▒╗╝¶ø]┴╦─ŪŠ══µ▓╗ŲüĒ┴╦ĪŻ┤╦═Ōė╔ė┌circRNA╩ŪŁh(hu©ón)ĀŅĄ─Ż¼╦∙ęįį┌║═miRNAĮY(ji©”)║ŽĢrŻ¼ūįė╔─▄Ą╚Ą╚ģóöĄ(sh©┤)┐ŽČ©Ģ■ė╔ė┌Ęųūėśŗ(g©░u)Ž¾░l(f©Ī)╔·Ė─ūāŻ¼╦∙ęįŅA£yĄ─£╩┤_ąįę▓Ģ■┤“š█┐█ĪŻ
|
¤ßķT╬─š┬Ż║
|
Łh(hu©ón)ĀŅRNAĄ─Öz£yąŠŲ¼
Arraystar circRNAąŠŲ¼▓╔ė├┴╦ßśī”╠ž«Éąį╝¶Įė³cĄ─╠ĮßśĪŻ ŠĆą═RNAĮø(j©®ng)▀^▓╗═¼Ą─ĘĮ╩ĮŲ┤ĮėŻ║═Ō’@ūėA Ą─5Ī»Č╦║══Ō’@ūėBĄ─3Ī»Č╦▀BĮėŻ¼ą╬│╔Łh(hu©ón)ĀŅRNAĪŻArraystaręįcircRNA╠ž«ÉąįŲ┤Įė╬╗³cū„×ķ░ąś╦ą“┴ąŻ¼įO(sh©©)ėŗąŠŲ¼╠ĮßśŻ¼╝┤╩╣į┌ŽÓæ¬(y©®ng)Ą─ŠĆąįRNA┤µį┌Ą─ŪķørŽ┬ę▓┐╔ęį£╩┤_Ą─Öz£ycircRNAĪŻ
|
|
Łh(hu©ón)ĀŅRNA╣”─▄蹊┐ėųę╗└¹Ų„--▀^▒Ē▀_▌d¾w
╝¬┘É╔·╬’└¹ė├īŻ└¹╝╝ąg(sh©┤)Ż¼│╔╣”čą░l(f©Ī)│÷╠ž«Éąį£╩┤_▀^▒Ē▀_ circRNAs Ą─▒Ē▀_▌d¾wŻ¼┬╩Ž╚×ķ蹊┐š▀╠ß╣®║å▒ŃĖ▀ą¦Ą─ circRNAs ▀^▒Ē▀_蹊┐▓▀┬įĪŻ¼F(xi©żn)ęč═Ų│÷ pCD-ciRĪópLO-ciR ║═ PLCDH-ciR ╚²ĘN circRNAs ▒Ē▀_▌d¾wŻ¼▀mė├ė┌Ųš═©šµ║╦▒Ē▀_Ż¼┬²▓ĪČŠ░³čbŻ¼ŠG╔½¤╔╣Ō║═Óč▀╩├╣╦ž║Y▀xĄ╚ČÓĘNė├═ŠĪŻ
|
|
╔²╝ē░µŁh(hu©ón)ą╬RNAöĄ(sh©┤)ō■(j©┤)Äņ
╔²╝ē░µĄ─Łh(hu©ón)ą╬RNAöĄ(sh©┤)ō■(j©┤)ÄņCIRCpeida v2╣▓╩šõø┴╦6éĆ╬’ĘNŻ©░³║¼╚╦ĪóąĪ╩¾Īó┤¾╩¾Īó░▀±R¶~Īó╣¹Žē║═ŠĆŽxŻ®ųą│¼▀^180éĆśėŲĘĄ─Łh(hu©ón)ą╬RNAėŗ╦ŃĘų╬÷ĮY(ji©”)╣¹ĪŻų„ę¬═©▀^CIRCexplorer2║═ MapSpliceėŗ╦Ń┴„│╠Įy(t©»ng)ėŗ½@Ą├┴╦262,782éĆŁh(hu©ón)ą╬RNAĘųūėŻ¼Ųõųą░³└©73,972éĆ┐╔ūāĘ┤Ž“╝¶Įė╩┬╝■ĪŻ
|
|
╩╣ė├š▀┐╔═©▀^Öz╦„║═Ž┬▌d─ŻēK½@╚ĪŁh(hu©ón)ą╬RNA╗∙ę“ĮMū°ś╦Īó▒Ē▀_╦«ŲĮĪó┐╔ūāĘ┤Ž“╝¶ĮėĪó╚╦╩¾▒Ż╩žąįĄ╚ČÓśė╗»ą┼ŽóŻ¼═©▀^×gė[─ŻēKį┌╗∙ę“ĮM╔ŽłDą╬╗»▓ķ┐┤Łh(hu©ón)ą╬RNAŠ▀¾w▒Ē▀_─Ż╩ĮŻ¼▓ó═©▀^ą┬Ą─į┌ŠĆĘų╬÷╣żŠ▀ī”▓╗═¼śėŲĘųąĄ─Łh(hu©ón)ą╬RNAķ_š╣▒╚▌^Ęų╬÷ĪŻ
|
|
|